[이데일리 김진수 기자] 한 주(9월 11일~9월 15일) 국내 제약·바이오 업계에서 주목받은 임상이다.
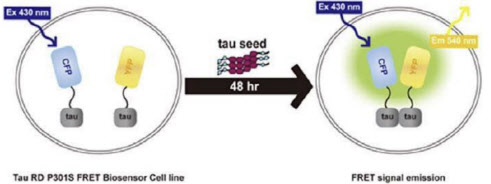 | | 오스코텍 치매치료제 ADEL-Y01 기전 모식도. (사진=오스코텍) |
|
오스코텍·아델, 치매치료제 ‘ADEL-Y01’ FDA 임상 승인오스코텍은 미국 식품의약국(FDA)으로부터 아델과 공동개발 중인 알츠하이머성 치매치료제 ADEL-Y01의 임상1a/1b상 계획을 승인 받았다고 14일 밝혔다.
미국에서 진행될 이번 임상시험은 정상인 및 환자를 대상으로 ADEL-Y01의 안전성과 내약성을 평가할 예정이다. 1a상에서는 정상인 40명을 대상으로 단일용량상승시험이 진행 될 예정이고, 1b상에서는 알츠하이머성 치매로 인한 인지장애 환자 또는 경증 알츠하이머 치매환자 33명을 대상으로 다중용량상승시험이 진행된다.
오스코텍은 지난 2020년 울산의대 서울아산병원 뇌과학교실 윤승용 교수가 창업한 아델과 타우 항체 ‘ADEL-Y01’의 연구개발과 상업화를 위한 공동연구개발계약을 체결한 바 있다.
ADEL-Y01은 타우 단백질 중에서도 정상 타우에는 작용하지 않고 알츠하이머성 치매를 포함한 타우병증의 핵심 병리 인자인 아세틸 타우(tau-acK280)만을 선택적으로 타깃하는 항체
후보물질이다.
윤태영 오스코텍 대표는, “ADEL-Y01은 저분자화합물 신약개발에 머물지 않고 바이오신약으로까지 저변과 역량을 확장해 가는 중요한 이정표가 될 것”이라고 설명했다.
윤승용 아델 대표는 “베타 아밀로이드 항체 신약 승인 이후 타우 타겟 치매 치료제에 대한 시장의 관심이 높아졌다”며 ““고통받는 환자들과 가족들에게 희망을 줄 수 있도록 임상시험에 최선을 다하겠다”고 말했다.
프레스티지바이오파마, 췌장암 항체신약 싱가포르 임상 1/2a상 승인프레스티지바이오파마는 싱가포르 보건과학청(HSA)으로부터 췌장암 항체신약 ‘PBP1510’의 임상 1/2a상 시험을 승인받았다고 지난 14일 밝혔다.
이는 미국을 포함해 스페인, 프랑스, 호주에 이은 다섯번째 국가의 임상 승인이다. 5개 국가에서 동시 진행될 임상 1상은 30명, 2a상은 50명을 모집한다.
임상 1상은 PBP1510의 단일요법 및 기존 항암제인 젬시타빈과의 병행요법을 통해 약물의 안전성과 내약성을 평가하게 된다. 이어 PBP1510 권장용량에 대한 안전성을 확인하고 약물의 효능을 평가하는 2a상을 진행한다.
PBP1510의 임상 1/2a상은 스페인에서 이미 환자 투약이 시작됐고, 미국은 FDA IND 승인후 하버드 의과대학 부속 매사추세츠 종합병원에서 생명윤리위원회(IRB) 심의를 통과하고 본격적인 투약 절차를 밟고 있다.
전세계 최고 임상시험수탁기관의 아태지역 본부 및 센트럴 랩 등 핵심 임상 인프라가 있는 싱가포르는 PBP1510의 첫번째 아시아 임상국가로 선정됐다. 싱가포르 임상 시험은 최대 규모 암센터인 싱가포르 국립암센터(NCCS)에서 진행되며, 싱가포르 국립암센터의 종양학 분야 수석 컨설턴트 의사이자 용루린(Yong Loo Lin) 의과대학의 임상 교수인 데이비드 테이 박사(Dr. Tai Wai Meng David)가 임상을 총괄한다.
프레스티지바이오파마 관계자는 “이번 임상 국가 추가 승인으로 PBP1510이 세계최초의 췌장암 치료제로 개발될 수 있는 가능성을 한층 더 넓힐 수 있게 됐다”며 “스페인에서의 첫 투약환자를 시작으로 환자 모집이 속속 이뤄지고 있고, 여러 나라의 임상 본격 시작으로 전 연구원이 유의미한 임상 결과를 도출할 수 있도록 총력을 기울일 것”이라고 말했다.
뷰노, 심정지 예측기기 전향적 연구 결과 국제학술지 게재뷰노는 ‘뷰노메드 딥카스’의 임상적 유효성을 최초의 전향적 연구를 통해 입증한 다기관 임상 연구논문이 중환자의학 분야 세계 최고 권위의 학술지 ‘Critical Care(IF 19.344)’에 게재됐다고 15일 밝혔다.
실사용 데이터를 활용한 전향적 연구는 다양한 변수가 존재하는 실제 임상 현장에서 획득한 데이터로 의료진의 신뢰도가 높다. 그간 AI 의료기기에 대한 연구는 대부분 이전 시점의 의료 데이터를 활용한 후향적 연구로 수행됐다. 이번 뷰노의 연구는 앞서 여러 후향적 연구를 통해 임상적 유효성을 입증해 온 뷰노메드 딥카스가 실제 임상 환경 및 전향적 연구에서도 일관된 예측 성능과 높은 신뢰성을 보였다는 점에서 의미를 갖는다.
뷰노 연구팀은 규모와 위치, 의료환경이 각기 다른 3차 의료기관 △서울대학교병원 △분당서울대학교병원 △인하대학교병원 △동아대학교병원의 일반병동에 입원한 환자 데이터를 활용한 다기관(Multicenter) 연구를 수행했다.
연구 결과, 뷰노메드 딥카스의 예측 성능은 예측 정확도를 나타내는 성능지표인 AUROC 기준 0.869로, 기존 방법들(NEWS 0.767, MEWS 0.756)에 비해 우수했다. 같은 민감도 대비 1000병상 당 알람 횟수도 절반 이상 감소했으며, 기존 방법들 대비 고위험 알람이 실제 의료진의 조치로 이어진 비율이 가장 높아 알람의 높은 신뢰도를 입증했다. 또 환자의 연령이나 성별, 발생 시간 등 별다른 제한없이 유효성을 보이는 것으로 나타났다.
이예하 대표는 “이번 연구 결과는 다양한 변수가 존재하고 난이도가 높은 최초의 다기관 전향적 연구를 성공적으로 수행함으로써 뷰노메드 딥카스의 일관된 예측 성능과 범용성을 입증했다는 데 큰 의미가 있다”라며 “향후 추가적인 전향적 연구를 수행하여 해당 제품에 대한 임상 현장에서의 신뢰도를 계속 높이는 동시에, 필수의료로서 더 많은 의료 현장에 도입돼 환자의 안전을 지킬 수 있도록 최선을 다하겠다”고 말했다.





 (좌측상단)
(좌측상단) (우측상단)
(우측상단) (우측상단)
(우측상단)







![[단독] 루닛, AI 흉부 X-ray 韓 첫 판매 돌입...무주공산 900억 시장 잡는다](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042200822b.jpg)