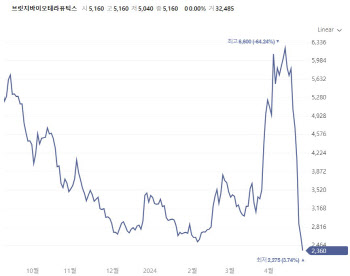
X

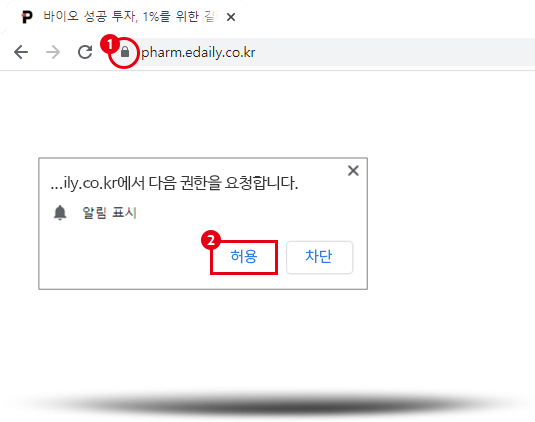


브라우저 좌측 상단에 그림과 같은 요청이 뜬다면
허용을 눌러 설정을 완료해 주세요.

요청이 뜨지 않았다면 다음 > 안내를 참고해 주세요.

 (좌측상단)
(좌측상단) (우측상단)
(우측상단) (우측상단)
(우측상단)
사용중인 브라우저의 주소창을 확인 후 알람아이콘아이콘을 눌러 허용해 주세요.
설정 즉시 브라우저 알림이 활성화 됩니다.






![[단독]글로벌 톱10 제약사, 신라젠 BAL0891 공동개발 협의중](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/05/PS24050200372b.jpg)