[이데일리 박미리 기자] 한 주(5월10일~5월14일) 가장 주목받은 임상은 동아에스티의 만성 판상 건선치료제 ‘DMB-3115’다.
동아에스티는 지난 11일 ‘DMB-3115’의 에스토니아 제3상 임상시험계획(IND)을 승인받았다고 밝혔다. 이에 따라 중등도에서 중증의 만성 판상 건선 환자를 대상으로 스텔라라와 DMB-3115의 유효성, 안전성, 면역원성을 비교하기 위한 임상이 진행된다. 방식은 무작위 배정, 이중 눈가림, 다기관, 평행 비교, 활성대조 시험 등이다.
 | | 동아에스티 전경(사진=동아에스티) |
|
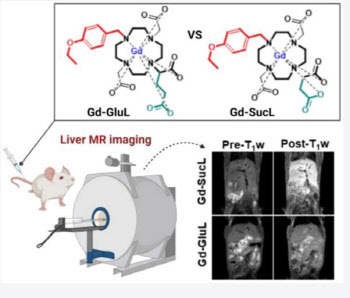
‘DMB-3115’는 의약품 시장조사기관 아이큐비아 기준 2019년 매출 7조원을 기록한 블록버스터 ‘스텔라라(성분명 우스테키누맙)’의 바이오시밀러(바이오의약품 복제약)다. 스텔라라는 면역 매개 물질인 인터루킨-12와 인터루킨-23이 공유하는 서브유닛 단백질 p40을 차단해 염증세포의 활성화를 억제하는 생물학적 치료제다.
앞서
동아에스티(170900)는 체코와 에스토니아, 조지아 등 9개국에 DMB-3115 임상 3상 사전 IND를 신청했다. 이중 에스토니아에서 최근 승인을 받은 것이다. 지난 3월에는 미국에서 임상 3상 IND 승인을 받아 환자 모집을 시작했다.
동아에스티는 임상을 완료한 후 스텔라라의 미국과 유럽 물질특허가 만료되는 2023년 9월과 2024년 7월에 맞춰 제품을 출시할 계획이다. 물질특허는 화학적 방법에 의해 제조된 신규 물질 그 자체에 부여되는 특허를 말한다. 또 임상 3상은 계열사인 디엠바이오에서 생산한 임상시료를 사용해 실시하기로 했다.
동아에스티 관계자는 “글로벌 시장에서 오리지널 바이오의약품의 특허 만료에 따라 바이오시밀러 시장이 지속 성장하고 있다”며 “DMB-3115의 글로벌 3상 임상을 성공적으로 마쳐 우수한 품질과 경제성을 두루 갖춘 바이오의약품을 글로벌 시장에 공급해 나가겠다”고 말했다.
현재 스텔라라 바이오시밀러를 개발 중인 경쟁사로는 암젠과 셀트리온(임상 3상), 삼성바이오에피스(임상 1상) 등이 있다.
다만 동아에스티는 이번 임상과 관련해 투자자에 유의사항을 전달했다. 동아에스티는 “임상시험 약물이 의약품으로 최종 허가받을 확률은 통계적으로 약 10% 수준으로 알려져 있다”며 “임상시험 및 품목허가 과정에서 기대에 상응하지 못하는 결과가 나올 수 있고 당사가 상업화 계획을 변경하거나 포기하는 가능성도 상존한다”고 했다.





 (좌측상단)
(좌측상단) (우측상단)
(우측상단) (우측상단)
(우측상단)





![[아미코젠 대해부①] 바이오 원료 국산화 선봉장 신용철 아미코젠 의장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/03/PS24032000190b.jpg)