[이데일리 송영두 기자] 유럽의약품청(EMA)이 코로나19 대응 중요 의약품 목록을 지정했다. 여기에는
셀트리온(068270) 렉키로나도 포함됐다. EMA로부터 귀한 대접을 받게 된 것. 한국바이오협회 ‘이슈브리핑’ 리포트에 따르면 EMA는 코로나19 예방이나 치료제 필요한 의약품으로 지정해 의약품 부족 현상을 상시 모니터링한다.
지난 7일 EMA 의약품부족운영위원회(MSSG)는 코로나19 공중보건 비상사태에 필요한 중요 의약품 목록을 채택했다. 목록에 포함된 의약품은 코로나19를 예방하거나 치료하기 위해 EU에서 승인된 모든 백신과 치료제가 포함됐다.
백신은 △화이자 코미나티(Comirnaty) △얀센 제이코브든(Jcovden) △노바백스 뉴백소비드(Nuvaxovid) △모더나 스파이크백스(Spikevax) △아스트라제네카 백스제브리아(Vaxzevria)가 채택됐다. 치료제로는 △덱사메타손 포함 의약품 △로슈 로악템라(RoActemra) △로슈 로나프레브(Ronapreve) △아스트라제네카 이부실드(Evusheld) △소비 키너렛(Kineret) △길리어드 베클루리(Veklury) △화이자 팍스로비드(Paxlovid) △GSK 제부디(Xevudy)가 포함됐다. 특히 국산 코로나19 치료제이자 셀트리온이 개발한 렉키로나도 채택됐다.
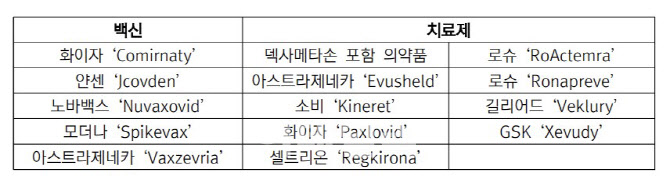 | | 유럽의약품청이 코로나19 대응 중요 의약품으로 지정한 코로나19 백신 및 치료제.(자료=한국바이오협회) |
|
EMA는 이를 통해 잠재적 또는 실제적 부족을 관리하기 위해 이들 의약품의 공급과 수요를 상시 모니터링 하게 된다. 의약품 판매 허가 보유자는 부족량, 사용 가능한 재고, 공급 및 슈요 예측에 대한 데이터를 포함해 관련 정보를 정기적으로 업데이트해야 한다.
EMA 지난 1월 31일 의약품부족운영위원회를 설립했다. 의약품 및 의료기기의 위기 대비 및 관리에 있어 EMA 역할을 강화하기 위한 것이다. 주요 사건 또는 공중보건 비상사태에 대한 대응을 모니터링하고 유럽연합 내 긴급조치를 조정하게 된다.
의약품부족운영위원회 주요 역할은 △공중보건 비상사태 동안 부족 위험 가능성이 있어 모니터링이 필요한 의약품 목록 설정 △중요 의약품 부족 예방 및 완화하기 위한 조치 권장 △중요 의약품의 품질, 안전성 및 효능에 관한 정보의 평가 △공중보건을 보호하기 위해 EU 집행위원회와 EU 회원국에 적절한 EU 수준 조치를 권고하게 된다.
EMA로부터 중요 의약품으로 지정받은 렉키로나는 셀트리온이 개발한 코로나19 치료제다. 2021년 2월 식품의약품안전처로부터 조건부 허가를 받았다. 국산 32호 신약으로 이름을 올렸다. 그해 11월에는 EMA가 렉키로나 허가 승인 권고를 내렸고, 하루만에 유럽연합집행위원회(EC)로부터 정식허가를 받아 유럽 시장에도 진출했다.
셀트리온헬스케어(091990)가 해외 시장에 공급했고, 국내에서는 질병관리청을 통해 공급된 렉키로나는 지난해 약 1500억원의 매출을 올렸다. 상용화 초기 조단위 매출까지 기대됐지만, 적응증의 한계와 코로나 백신 상용화, 오미크론 변이 확산 등으로 기대만큼 매출을 올리진 못했다. 특히 오미크론에는 큰 효능이 없다고 분석되면서 국내에서는 공급이 중단됐다.



![[부고]서홍민(엠투엔그룹 회장)씨 모친상](https://image.edaily.co.kr/images/content/defaultimg.jpg)


![양동원 서울성모병원 부원장 “레켐비·슈퍼브레인 병용, 치매 진행 지연 효과”[전문가 인사이트]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/02/PS26021700064b.jpg)
![냉탕 온탕 오간 에이프릴바이오…실적 호조에 로킷·휴젤 상승[바이오맥짚기]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/02/PS26021200275b.jpg)

