[이데일리 박미리 기자] ‘국내 1호 디지털 치료제’ 탄생 여부를 놓고 업체들 간 해석이 엇갈리고 있다. 어디선 “우리가 국내 1호 디지털 치료제”라고, 어디선 “아직 국산 디지털 치료제는 나오지 않았다”고 각각 주장하는 상황이다.
 | | 로완 ‘슈퍼브레인’(자료=로완) |
|
7일 업계에 따르면 뇌 질환 디지털 치료기업 로완은 지난 6월 “다중영역중재 치매 예방 디지털 프로그램 ‘슈퍼브레인’을 개발, 올해 1월 국내 최초로 신의료기술인 인지중재치료를 기반으로 디지털화해 상용화하는 데 성공했다”는 문장이 담긴 자료를 냈다. 이어 지난 5일에는 업무협약(MOU) 소식을 전하는 자료에서 “로완의 슈퍼브레인은 국내 최초로 신경과 전문 의료진과 함께 개발하고 임상까지 마친 디지털 치료제”라고 표현했다. ‘국내 1호 디지털 치료제’를 개발했다고 소개해온 셈이다.
그러나 국내 디지털 치료제 업체들은 “국산 디지털 치료제는 아직 나오지 않았다”며 이 같은 주장을 부인하고 있다. 이중 사실은 무엇일까. 결론부터 말하면 “식약처 인증을 받은 국산 디지털 기기는 아직 탄생하지 않았다”는 것이다.
인허가 가이드라인 지난해 마련 국내에서 디지털 치료기기 인허가 가이드라인이 나온 건 작년 8월이다. 식품의약품안전처는 여기에서 디지털기기를 ‘의학적 장애나 질병을 예방, 관리, 치료하기 위해 환자에게 근거 기반(임상을 통해 질병 치료 안전성 및 효능 입증)의 치료적 개입을 제공하는 소프트웨어 의료기기’라고 정의했다. 의료기기라는 점을 감안해 공식 명칭은 ‘디지털 치료기기’로 정했다.
또 소프트웨어 의료기기는 ‘하드웨어에 종속되지 않고 의료기기 사용 목적에 부합하는 기능을 가지며 독립적인 형태의 소프트웨어만으로 이루어진 의료기기’를 뜻한다. 이에 식약처는 당시 가이드라인에서도 인허가를 준비하는 업체들에 “‘의료기기 소프트웨어 기술문서 작성방법’을 참고해 작성하되 디지털 치료기기 특성에 따라 추가적으로 작용원리, 사용목적, 성능 등의 기재사항을 고려해야 한다”고 제시했다.
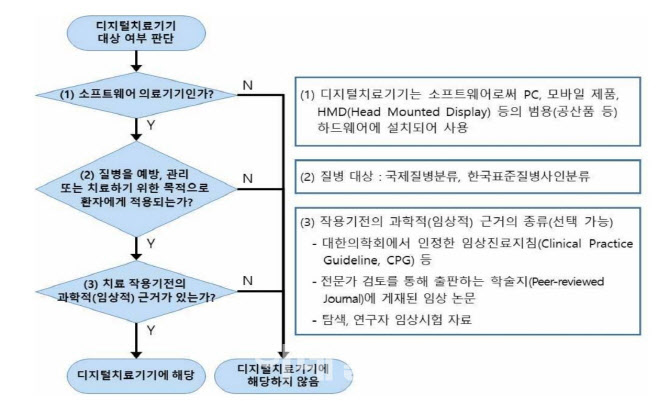 | | 디지털 치료제 대상여부 판단기준 및 절차(자료=식약처) |
|
“의료기기 품목허가 X” 슈퍼브레인은 환자가 앱을 통해 과제를 수행하는 형태로 ‘소프트웨어 의료기기를 지향하나’, 2020년 8월 식약처의 ‘디지털 치료기기 허가심사 가이드라인’이 나오기 전에 보건복지부의 과제를 통해 개발된 프로그램이기 때문에 식약처의 인증을 받은 디지털치료기기가 아니다”라는 것이 업계의 입장이다.
현재 국내에서 디지털 치료기기 가이드라인에 맞춰 확증임상 단계를 밟고 있는 회사는 뉴냅스, 라이프시맨틱스, 에임메드, 웰트 4곳이다. 임상 단계로만 보면 내년께 이중 첫 디지털 치료제가 나올 가능성이 큰 것으로 관측된다. 디지털 치료제는 의료기기로 분류돼 동물을 대상으로 하는 전임상 단계가 없다. 사람 대상 임상 역시 임상 1상과 2상에 해당하는 탐색임상과 임상 3상에 해당하는 확증임상 두 단계만 거치면 된다.
로완 측은 ‘디지털 치료제’ 개념에 대한 해외, 국내 기준 차이를 혼동해 빚어진 용어사용의 시점차이라는 입장이다. 로완 관계자는 “2017년 미국 피어테라퓨틱스가 디지털 치료제라는 용어를 처음 사용했다”며 “로완은 이후 국내에서 복지부와 보건산업진흥원의 후원을 받아 SW를 활용한 치매예방프로그램의 임상연구를 진행했고, 연구를 통해 SW프로그램을 활용한 치매예방효과를 확인했다. 이후 식약처의 공식 가이드라인이 나오기 전인 2018년부터 국내에서 처음 ‘디지털 치매 치료제’라는 명칭을 사용해온 게 이러한 혼동을 가져온 것 같다”고 전했다. 피어테라퓨틱스는 약물중독 치료앱 ‘리셋’을 통해 미국에서 처음 디지털 치료제 허가를 받은 기업이다.
이어 로완 측은 “최근 식약처에 슈퍼브레인의 디지털 치료기기 등재여부에 대해 질의했다”며 “보건복지부의 임상결과와 별도로 알고리즘이 포함돼야 한다는 회신을 받은 상태”라고 했다.
한편 로완은 최근 식약처에 디지털 치료기기 등재여부를 위한 의료기기 해당 여부 질의를 했고, 의료기기 정의에 부합되므로 의료기기에 해당되나 의료기기 인증을 위해서는 보건복지부의 임상결과와 별도로 식약처의 확증 임상실험을 통해 유효성 입증이 필요하다고 회신 받은 상황이다.






![LG 출신 김현수 대표, 독보적 광학 기술로 글로벌시장 접수[휴비츠 대해부①]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/03/PS26030800061b.jpg)




