[이데일리 김진호 기자] 유전성 희귀 신경근육질환인 ‘듀센(뒤센) 근이영양증’(DMD)을 완치할 목적의 유전자 치료제 신약의 등장 임박했다. 미국 사렙타 파마슈티컬스(사렙타)의 DMD 대상 유전자 치료제 후보물질 ‘SRP-9001’에 대한 미국 식품의약국(FDA) 자문위원회의 가속 승인 권고 결정이 나오면서다. 미국 화이자도 관련 유전자 치료제 후보의 임상 3상으로 사렙타를 바짝 쫓고 있다.
반면 지난해 미국 나스닥에 상장한 ‘펩젠’은 ‘안티센스 올리고 뉴클레오타이드’(ASO) 기반 DMD 신약 후보 임상을, 국내 바이오텍 큐라미스는 신세념 세포융합 치료제로 DMD 시장에 도전한다는 계획이다.
 | | 남아에서 체내 근육의 이상 발달을 일으키는 듀센(뒤센) 근이영양증에 대한 완치법은 아직 없다.(제공=FDA) |
|
DMD는 X염색체에 있는 디스트로핀 유전자 이상으로 팔이나 다리, 몸통 등에 위치한 근육이 비정상적으로 발달하는 질환이다. X염색체 연관 열성유전이기 때문에 남아에서만 3500명 중 1명꼴로 발병하며, 2~4세 소아기때 첫 증상을 인지하게 된다.
16일 제약바이오 업계에 따르면 현재까지 개발된 DMD 완치제는 없다. 다만 미국 승인 기준 ASO 기반 DMD 치료제는 4개 시판됐다. 이중 3개를 사렙타가, 나머지 1개는 일본 닛폰제약이 보유하고 있다.
2016년부터 미국이나 일본 등 주요국에서 허가받은 ASO 치료제는 유전자 결함이 있는 염색체의 엑손(EXON) 부위를 뛰어 넘어 일부가 잘못 됐더라도 정상 단백질을 일정량 합성하도록 돕는 기술이 적용됐다. 이른바 ‘엑손 스킵핑’이다.
사렙타가 보유한 ‘엑손디스(Exondys)51’과 ‘바이온디스(Vyondys)53’, ‘아몬디스(Amondys)45’는 각각 EXON51과 53, 45 부위를 건더 뛰도록 만든다. 닛폰제약의 ‘빌텝소’도 EXON53을 건너뛰게 만든다. 이밖에도 코르티코 스테로이드제제가 병의 지연 용도로 사용되는 것으로 알려졌다.
그런데 최근 이 질환을 완치할 수 있는 최초 유전자 치료제의 등장을 눈앞에 둔 상황이다. 지난 12일(현지시간) 사렙타는 자사의 ASO 기반 신약 후보 SRP-9001(디란디스트로진 모세파보벡)에 대해 FDA 자문위가 가속 승인 권고 결정을 내렸다고 밝혔다. 이달 29일로 예정된 SRP-9001허가 심사 결론이 긍정적으로 나온다는 의견에 무게가 실린다.
SRP-9001은 디스트로핀 유전자 문제를 해결하기 위해 정상 서열을 아데노연관바이러스(AAV)를 통해 전달하는 방식으로 개발됐다. 사실상 초고가 단회 투여로 이상 유전자를 교정해 병의 완치를 기대할 수 있는 약물인 셈이다.
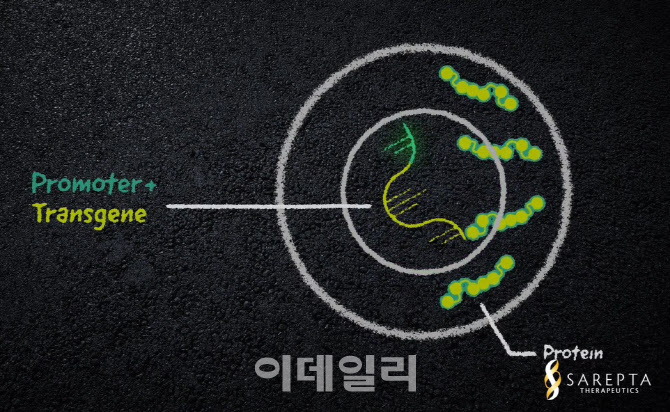 | | 뒤센 근이영양증(DMD) 대상 유전자 치료제 ‘SRP-9001’의 개념도. 교체하려는 유전자와 이를 활성화하는 프로모터, 전달체로 아데노연관바이러스(AAV)를 활용한 SRP-9001을 넣어주면 이상 유전자를 대체해 정상적인 디스트로핀 단백질을 생성할 수 있다.(제공=사렙타 파마슈티컬스) |
|
ASO에서 유전자 치료제로 확장하며 DMD 시장의 맹주로 자리를 굳히려는 사렙타를 추격하는 대표 기업은 미국 화이자다. 회사는 현재 자사의 ‘PF-06939926’(포다시스트로진 모바파보벡)에 대한 DMD 적응증 관련 미국 등 글로벌 임상 3상을 진행 중이다. 해당 물질 역시 AAV기반 유전자 전달기술로 개발됐다.
다만 이 같은 DMD 대상 유전자 치료제의 부작용 위험과 실효성 등은 남은 숙제다. PF=06939926으로 진행하던 다른 적응증의 임상 1b상 단계에서 사망자가 나와. DMD 관련 임상 3상도 중단됐다가 지난해 4월 재개됐다. 사렙타의 SRP-9001은 사망자가 나온 것은 아니지만 임상 1상 단계에서 간세포효소 상승이 관찰돼 이슈를 모으기도 했다. 이 약물은 2021년 임상 3상 결과 효능 미충족 결과를 내놓은 바 있다. 이후 사렙타가 디자인을 변경한 추가 임상을 운동성 관련 지표를 확보했다.
사렙타 측은 SRP-9001의 필요성을 재차 강조하고 나섰다. 덩 인그람 사렙타 CEO는 “FDA의 승인 결정이 나오면, 빠르게 시장에 출시할 계획”이라며 “사실상 모든 환자가 기존 치료제로 소용없어 새로운 치료법이 절실하다”고 강조했다. 참고로 사렙타의 DMD 관련 치료제들의 글로벌 상업화 권리는 스위스 로슈가 보유하고 있다.
한편 지난해 나스닥에 상장한 미국 펩젠은 사렙타가 선점한 ASO 시장을 노리고 있다. 회사는 지난해 9월 자사의 엑손51을 건너뛰도록 하는 ASO 기반 DMD 신약 후보 ‘PGN-EDO51’의 임상 1상에 성공했다고 발표했다. PGN-EDO51의 엑손51 스키핑 효율은 용량별로 1.4~2%로 사렙타의 동종 약물(0.2% 이하) 대비 크게 높았다는 내용이었다.
국내 바이오텍 중 큐라미스가 세포융합 기술 기반 신개념 DMD 신약 후보 ‘CUR101’의 전임상을 진행하는 중이다. 회사 측은 “세포융합은 건강한 세포가 이상 유전자가 발현된 세포와 융합돼 회복을 유도하는 기술”이라며 “마우스 실험에서 CUR101 주입시 6개월관 근력 회복 효과를 확인했다”고 전했다.
시장조사업체 글로벌인포메이션은 지난 2020년 DMD 치료제 시장 규모가 2019년 기준 6억7214만 달러이며, 매년 42%씩 성장해 2026년 77억 달러에 이를 것으로 전망을 내놓은 바 있다. 최근 이런 예측치마저 큰폭으로 상회할 수 있다는 의견이 나온다. 유전자 치료제 개발 업계관계자 “SRP-9001은 최소 수억원 이상의 약가가 책정될 수 있고, 대안이 없는 환자가 많아 시장 개척 효과도 누릴 수 있을 것”이라며 “유전자 치료제 등 신개념 치료제가 DMD 적응증을 승인받기 시작하면 전체 규모도 기존 예측을 크게 뛰어넘을 것이다”고 설명했다.




![이슈의 중심 위고비...단 식품업계에도 영향 [클릭, 글로벌 제약·바이오]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/02/PS26021500374b.jpg)



![냉탕 온탕 오간 에이프릴바이오…실적 호조에 로킷·휴젤 상승[바이오맥짚기]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/02/PS26021200275b.jpg)


!["美진출하려면 中임상해도 美환자 최소 20% 참여해야"[제약·바이오 해외토픽]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/02/PS26021400157b.jpg)