[이데일리 나은경 기자] 티움바이오가 혈우병 치료제 파이프라인 임상 진입에 속도를 낸다. 우선 3분기 중 혈우병 우회인자 치료제 후보물질인 ‘NBP604(TU7710)’의 글로벌 임상 1상 개시를 목표로 오는 7월 임상시험계획(IND)을 신청할 예정이다.
4일 제약·바이오 업계에 따르면 김훈택 티움바이오 대표이사는 오는 13일 ‘2022 바이오코리아’에 참가해 올해 첫 기업설명회(IR)를 열고 NBP604를 비롯한 6개 파이프라인의 임상 진행상황을 발표할 예정이다.
 | | 김훈택 티움바이오 대표이사 (사진=티움바이오) |
|
올 하반기 혈우병 치료제 후보물질 임상 1상 진입 NBP604는 혈우병 환자 중 중화항체 발생으로 기존 혈우병 치료제에 대한 내성반응이 생긴 환자들을 대상으로 하는 치료제다. 혈우병 환자 중 치료제에 대한 중화항체를 보유하는 비중은 약 20~30% 수준으로 알려져 있다. 글로벌 시장조사업체 데이터모니터 헬스케어에 따르면 주요 7개국(미국, 프랑스, 독일, 이탈리아, 스페인, 영국, 일본)의 혈우병 우회인자 치료제 시장의 규모는 2016년 기준 15억달러(한화 약 1조9000억원)다. 오는 2025년에는 16억달러(2조300억원) 규모로 늘어날 것으로 예상된다.
이 분야 대표 제품은 덴마크 제약사 노보 노디스크의 노보세븐이다. 노보세븐은 반감기가 2.5시간으로 짧아 혈우병 환자가 발치 등 작은 규모의 수술을 하더라도 수일간 2~3시간마다 계속 투여해야 한다는 단점이 있다. 반면 NBP604는 경쟁약품 대비 반감기가 2~3배 길어 편의성이 높을 것이라는 게 회사측 설명이다.
NBP604는 올 초 IND 신청 후 상반기 중 임상 1상을 개시할 것으로 예상됐었다. 이에 대해 티움바이오 관계자는 “(IND 일정이 예상보다 늦춰진 건) 사내 임상 인력이 부족했기 때문”이라며 “면역항암제와 자궁내막증 치료제 후보물질 임상에 주력하고 있었는데 지난해 말 혈우병 치료제 후보물질을 전담하는 시니어 매니저급 임상 인력을 충원했다. 7월 초에는 NBP604의 IND를 신청할 것”이라고 말했다.
NBP604의 임상 1상 임상시험수탁기관(CRO)은 아이큐비아이며 현재 임상시료는 생산이 완료된 상태다. 피험자 수는 10명 규모로 예상된다.
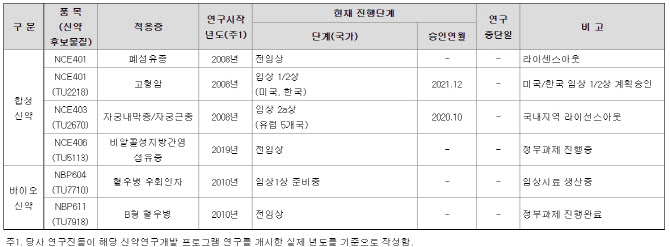 | | 티움바이오의 연구개발 진행 총괄표 (자료=티움바이오 사업보고서) |
|
“자궁내막증·면역항암제 임상 순항…연내 기술이전 기대” 티움바이오의 주요 파이프라인은 크게 합성신약과 바이오신약 두 갈래로 나뉜다. 이중 합성신약실에서 담당하는 자궁내막증 치료제 후보물질 ‘NCE403(TU2670)’과 면역항암제 ‘NCE401(TU2218)’의 임상단계가 가장 앞서 있다. NCE403은 현재 유럽 5개국에서 임상2a상을 진행 중이며 NCE401은 지난해 12월부터 미국과 한국에서 임상 1/2상을 하고 있다.
이에 비해 바이오신약실에서 개발 중인 혈우병 우회인자 치료제 후보물질인 NBP604와 B형 혈우병 치료제 후보물질 NBP611의 임상 진행은 상대적으로 더디게 진행됐다. 티움바이오는 현재 전임상 단계에 있는 NBP611은 이르면 내년 말께 임상 1상이 개시될 것으로 예상하고 있다.
회사측은 주력 파이프라인인 NCE403과 NCE401의 임상 역시 순항 중이라고 설명했다. 오는 13일 열릴 IR에서는 NCE403과 NCE401의 임상 중간결과에 대해서도 개략적으로 공유될 것으로 보인다. 둘 다 올해 기술이전 가능성이 기대되는 후보물질이다.
티움바이오 관계자는 “NCE401은 총 6개 코호트(동일집단) 중 첫 번째 용량군인 코호트1(30mg) 투약이 중단되는 일 없이 마무리 단계에 접어든 상태로 이르면 다음주 중 코호트2(60mg) 투약이 개시될 예정”이라며 “바이오코리아에서 진행할 IR에서 NCE401의 임상 진행 상황을 업데이트할 수 있을 것”이라고 말했다. 이어 자궁내막증 치료제 후보물질에 대해서는 “NCE403은 이중맹검으로 임상 2a상이 진행 중이기 때문에 정확한 중간데이터 값을 알 수는 없다”면서도 “자궁내막증의 주 평가지표 중 하나인 통증 완화 부분에 있어서는 대부분의 환자들로부터 긍정적인 피드백을 받았다”고 했다.










![[임상 업데이트] 보로노이 VRN10, 임상 1상서 ‘완전관해’ 달성](https://image.edaily.co.kr/images/vision/files/NP/S/2025/11/PS25110100221b.jpg)