[이데일리 김진호 기자] 이스라엘 메디운드 리미티드(메디운드)의 중증 화상 치료 신약 ‘넥소브리드’가 미국에서 모든 연령에게 쓸 수 있도록 적응증이 확장되면서 시장의 기대를 받고 있다. 이 약물이 2030년경 5조원 내외로 성장할 글로벌 화상 치료 시장의 블루칩으로 성장할 수 있다는 전망이 나온다.
국내에서는 테고사이언스(191420)가 출시 중인 화상 치료제 ‘칼로덤’의 일본과 미국 등 해외 진출을 시도하고 있다. 강스템바이오텍(217730)의 계열사인 프리모리스테라퓨틱스(프리모리스)도 엑소좀 기반 세포 신약 후보물질에 대해 화상 대상 호주 내 임상 1/2a상에 진입하면서, 글로벌 시장 진출 전략을 마련하고 있다.
 | | 이스라엘 메디운드 리미티드의 ‘넥소브리드’가 미국에서 전연령에 사용할 수 있게 되면서 중증 화상 치료제 중 두각을 보이고 있다. 테고사이언스는 세포 기반 화상 치료제 ‘칼로덤’의 일본과 미국 등 해외 진출을 시도하는 중이다.(제공=게티이미지, 각 사) |
|
韓서 품목취하된 ‘넥소브리드’, 미국서 적용 연령 확대 성공 시장조사업체 그랜드 뷰 리서치는 글로벌 화상 치료 시장이 2022년 22억 달러에서 2030년경 40억 달러(한화 약 5조3000어억원)로 성장할 전망이다. 미국 국립보건원(NIH)에 따르면 매년 25만 5000명이 화상으로 사망하며, 이중 절반의 사망자가 중동 지역에서 발생하고 있다.
화재로 인한 치명적인 화상 환자의 96%는 중저소득 국가에서 발생하는 것으로 분석됐다. 일례로 인도나 방글라데시에서는 각각 약 100만 명과 17만명의 중등도에서 중증의 사망환자가 매년 발생하는 것으로 알려졌다. 반면 국내에서는 최근 10여 년 동안 매년 40만~60만 명 안팎의 화상 환자가 발생하고 있으며, 이중 중증 환자는 전체의 10% 안팎이다.
화상 치료 업계 한 관계자는 “시장성이 큰 것은 중저소득 국가일 수 있지만, 다른 약물과 마찬가지로 상징성이 큰 미국이나 유럽 연합(EU) 시장 진출은 필수적이다”며 “첨단의약품이 아닌 일반적 약물은 미국식품의야국(FDA)의 승인이 나오면 중저소득 국가는 비교적 빠르게 진출하는 게 가능하다”고 설명했다.
이런 상황에서 가장 두드러지고 있는 약물이 메디운드의 넥소브리드(성분명 아나카울라스)다. 이 약물은 파인애플 줄기에서 유래한 천연물 치료제이며, 화상 환자에게 피부 이식 전 발라주면 가피(괴사 조직) 제거에 효과적인 것으로 알려졌다. 넥소브리드는 국내 식품의약품안전처(식약처)로부터 2018년 중중 화상으로 인한 가피 제거제로 승인됐지만, 2022년에 품목 취하된 바 있다.
하지만 글로벌 시장에서 넥소브리드의 시장성은 높아지고 있다. 넥소브리드는 EU와 인도 일본 등 40여 개국에서 성인 대상 화상 환자의 가피 제거 용도로 쓰이고 있다. 그런데 지난 15일(현지시간) FDA가 넥소브리드의 적용 연령을 신생아까지 확대 승인했다. 넥소브리드의 소아 등 투약 연령 확대를 위한 추가 임상 3상은 미국 보건부(HHS)의 지원 하에 진행됐다. 미국 정부 주도 추가 임상을 통한 결과로, 넥소브리드의 적용 연령이 다른 국가에서도 확대되는 조치가 이어질 것이란 분석이 나온다. 사실상 넥소브리드가 중증 화상 치료 시장의 주요 약물로 떠오르게 된 셈이다.
저소득국가 진출 보류한 테고사이언스, 日·美 시장 정조준 국내에서는 대표적 세포치료제 기업인 테고사이언스가 글로벌 화상 치료 시장 진출을 시도하고 있다. 회사가 노리는 주요 시장은 일본과 미국이다.
테고사이언스는 2000년대 중반부터 국내에서 2종의 화상치료제를 주력 상품으로 출시하고 있지만 그 매출은 제한된 시장 특성상 다소 정체된 상황이다. 실제로 회사는 식약처로부터 2002년과 2005년에 순서대로 ‘홀로덤’과 칼로덤을 승인받았다. 홀로덤은 자가유래 세포로 만든 것이고, 칼로덤은 동종유래 세포로 만든 물질이다. 홀로덤은 신체 표면적의 30%이상 차지하는 심한 2도 화상 및 신체 표면적의 10% 이상을 차지하는 3도 화상 치료 적응증을 보유하고 있다. 칼로덤은 심부 2도 이상 화상 치료와 당뇨병성 족부궤양(2010년 식약처 추가 승인) 치료 적응증을 보유하고 있다.
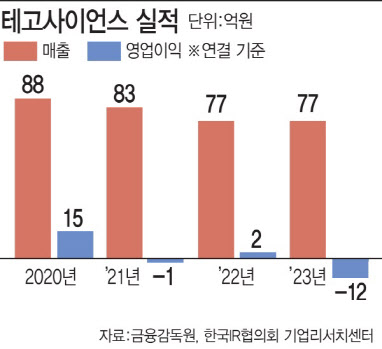 | | (그래픽=이데일리 김일환 기자) |
|
최근 4년새 테고사이언스의 매출은 2020년 88억원→2021년 83억원→2022년 77억원→2023년 77억원 등을 기록하는 등 큰 변화가 나타나지 않고 있다. 회사 매출의 80%가량이 칼로덤을 통해 나오는 상황이다. 이를 타개하기 위해 회사 측은 칼로덤의 첫 해외 무대로 일본 시장 진출을 시도하는 중이다.
테고사이언스 관계자는 “중증 환자가 많이 나오는 몽골이나 인도 등 중저소득 국가를 진출하려고 먼저 시도했다”며 “하지만 첨단의약품인 세포체료제 대해 현지에 공장을 세워야하는 등 진출을 어렵게 하는 부분이 있었다”고 했다.
그는 이어 “재생의료와 세포치료 분야에서 수십 년의 선진 경험을 쌓은 일본과 미국으로 눈을 돌리게 됐다”며 “칼로덤의 일본 진출을 위해 관련 당국인 후생노동성과 논의가 오갔지만, 아직은 이렇다 할 진전은 없는 상태다”고 설명했다.
그럼에도 테고사이언스은 “일본 내 1000억원 규모의 화상 치료 시장을 정복할 유력 약물이 칼로덤일 것”이라고 자신한다. 동종 유래 세포 기반 화상 치료제로 개발된 약물이 일본에 없기 때문에, 해당 시장에 진입할 결우 차별화 전략을 펼칠 수 있다는 계산이다.
27일 팜이데일리의 취재를 종합하면 칼로덤의 미국 시장 진출은 다른 주력물질의 개발 상황과 맞물려 진행돼야하는 상황인 것으로 파악됐다. 현재 테고사이언스는 미국에서 세포 기반 회전근개파열 치료 신약 후보물질 ‘TPX-115’의 임상 2상 진입을 준비 중이다.
회사 관계자는 “미국에서도 세포치료제 개발 시 임상물질을 생산할 공장을 마련해야 한다”며 “TPX-115가 승인받으면 투자를 통해 공장 건설을 진행하고, 이와 동시에 칼로덤의 미국 시장 승인 절차를 개시할 것”이라고 말했다. 다만 TPX-115 임상 역시 아직 FDA와 논의만 진행된 상태다.
 | | 지난 7월 강스템바이오텍의 계열사 프리모리스테라퓨틱스의 화상 치료 신약 후보물질 ‘PMS-101’이 호주 내 임상 1/2a상 진입에 성공했다.(제공=강스템바이오텍) |
|
◇프리모리스, 호주서 신약 임상...“미국 규격에 맞춰 진행” 이외에도 지난달 26일 프리모리스가 호주 식품의약품안전청(TGA)으로부터 줄기세포 유래 엑소좀 기반 화상치료 신약 후보 PMS-101의 임상 1/2a상을 승인 받았다. PMS-101이 피부조직의 재생과 염증 억제 등의 기능을 수해, 피부 조직의 회복을 촉진할 수 있다는 설명이다. 회사 측은 PMS-101의 호주 임상을 교두보 삼아 미국과 EU 등 글로벌 임상에 나설 예정이다.
나규흠 프리모리스 대표는 “호주 임상시험은 미국의 임상 규격을 지켜 수행할 경우 해당 데이터를 인정받아 추후 미국, 유럽 등 글로벌 임상 진행의 토대를 마련할 수 있다”며 “빠른 상업화를 위해 임상 진입부터 추후 임상 진행 방향 및 사업전략 등을 수립한 만큼 이번 임상 1/2a상에서 PMS-101의 안전성과 탐색적 유효성을 확보하는데 주력하겠다”고 말했다.





![“AI로 암 치료 ‘진단’ 넘어 ‘관리’로… 병원 아닌 보험사와 손잡은 니드[GAIF 2025]](https://image.edaily.co.kr/images/vision/files/NP/S/2025/11/PS25110400678b.jpg)



![HLB '베팅'소식에 급등,·SK바사·프로티아 호실적[바이오맥짚기]](https://image.edaily.co.kr/images/vision/files/NP/S/2025/11/PS25110500411b.jpg)


![[단독]삼성바이오에피스와 손잡은 프로티나, 'AI 항체 설계' 본격 행보](https://image.edaily.co.kr/images/vision/files/NP/S/2025/11/PS25110600109b.jpg)