[이데일리 김진수 기자] 에이비온이 적극적인 자금 확보에 나서면서 개발 중인 비소세포폐암 c-MET 돌연변이 표적 치료제 ‘바바메킵’(개발코드 ABN401)의 임상도 순항하고 있다. 바바메킵은 내년 희귀의약품 지정이 기대되며, 경쟁 약물 대비 뛰어난 효과와 안전성을 보여 기술수출 가능성도 높은 것으로 분석된다.
23일 금융감독원 전자공시시스템에 따르면 에이비온의 올해 연구개발 비용은 200억원을 돌파할 전망이다.
에이비온의 연구개발 비용은 2021년 바바메킵의 미국 임상 1·2상을 승인 받은 뒤 크게 증가했다. 2021년 68억원 수준이던 연구개발 비용은 미국 임상이 본격화된 2022년 196억원까지 늘었다. 올해는 3분기까지 184억원을 투입했다. 현재 추세대로라면 올해 에이비온의 연구개발 비용은 240억원까지 늘어날 것으로 추정된다.
연구개발에 대한 비용 부담이 늘어나면서 에이비온은 자금 확보에 적극적인 자세로 임하고 있다.
2021년 말 156억원이던 ‘현금 및 현금성 자산’은 2022년 말 42억원으로 대폭 줄었다. 이에 올해는 단기금융자산 130억원 가량을 현금 및 현금성 자산으로 전환시켰으며, 3분기말 기준 현금 및 현금성 자산은 다시 170억원으로 늘었다.
또 에이비온은 지난주 연구개발 비용 등을 포함한 운영자금을 마련하기 위해 텔콘알에프제약 및 젠큐릭스를 상대로 80억원 규모 제3자배정 유상증자를 결정했다. 이에 앞서 또 한 차례 유상증자를 통해 5억원을 운영자금을 확보한 상황이다.
에이비온의 파이프라인을 살펴보면 바바메킵과 항바이러스 예방치료제 ‘ABN101’, 고형암 치료제 ‘ABN501’ 등이 있으나 본 임상 단계가 진행 중인 물질은 바바메킵이 유일하다. 따라서 이번에 확보된 자금 대부분은 바바메킵의 임상 및 연구개발에 투입될 것으로 보인다.
특히, 이달 초에는 바바메킵이 국가신약개발사업단(KDDF) 주관 ‘제3차 국가신약개발사업 신약 임상개발 신규 지원 과제’에 최종 선정되면서 향후 2년간 총 70억원 규모의 연구개발비를 지원 받는 만큼 임상에 속도가 붙을 전망이다.
에이비온은 “확보한 자금을 통해 바바메킵 글로벌 임상 2상 완료 등을 목표로 하고 있다”고 말했다.
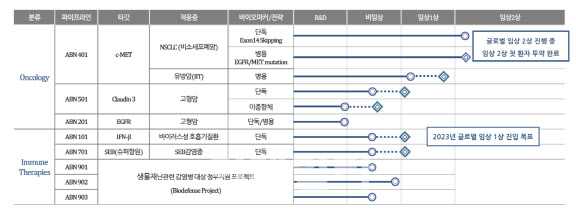 | | 에이비온 파이프라인 |
|
경쟁 약물보다 ‘효과’와 ‘안전성’ 우수바바메킵의 경쟁 약물은 노바티스 ‘타브렉타’와 머크 ‘텝메코’로 이미 시판 중이다. 에이비온 바바메킵은 시장에서 후발주자이지만 뛰어난 유효성과 안전성 데이터를 기반으로 내년 기술수출을 기대하고 있다.
에이비온은 올해 10월 AACR-NCI-EORTC에서 바바메킵의 글로벌 임상 2상 중간 결과를 공개했다. ‘AACR-NCI-EORTC’는 미국암학회(AACR)와 미국국립암연구소(NCI), 유럽 암 연구 및 치료기구(EORTC)가 공동 주최하는 정례 학술대회다.
바바메킵 임상 2상은 미국·한국·대만에서 진행되고 있다. 중간 결과 데이터는 총 17명의 MET 돌연변이 Exon14 유전자 결손 비소세포폐암 환자를 대상으로 도출됐다. 이 데이터를 살펴보면, 전체 환자 대상 객관적 반응률(ORR)은 52.9%(9명)로 나타났다. 이전에 치료 이력이 없는 8명의 환자에서는 ORR이 75%(6명)로 집계됐다.
이미 시판 중인 경쟁약물 노바티스 ‘타브렉타’와 머크 ‘텝메코’의 경우 각각 ORR이 48%(치료 이력 없는 환자에서 68%), 43%(치료 이력 없는 환자에서 43%)로 미국 식품의약국(FDA)의 가속승인(Accerated Approval)을 획득한 바 있다.
바바메킵 안전성과 관련해서도 인상적인 데이터가 지속적으로 도출되고 있다. 임상 1상에서 바바메킵을 투여 받은 환자 중 3등급 이상의 이상반응이 ‘0건’으로 전무했다. 임상 2상에서는 24명 중 2명(8.3%)에게만 3등급 이상의 ‘치료 관련 부작용’(TRAE)이 나타났다. 치료 관련 부작용으로 약물을 중단한 사례도 없었다.
타브렉타와 텝메코의 3등급 약물 이상반응이 37%와 28%로 집계된 점을 고려했을 때 안전성 측면에서도 훨씬 뛰어난 결과를 보인 셈이다.
에이비온은 이번 임상 2상 데이터를 정리해 본격적인 기술수출에 나선다는 방침이다. 미국의 터닝포인트테라퓨틱스가 지난 2021년 중국 바이오 기업에 c-MET을 표적으로 하는 치료제 파이프라인을 약 4000억원 가량에 기술수출 한 사례가 있는 만큼 바바메킵도 5000억원 안팎의 기술수출 계약을 체결할 가능성도 있다.
에이비온 관계자는 “임상 2상 중간 데이터는 바바메킵의 ‘베스트 인 클래스’(Best-in-class) 가능성을 증명한 것”이라며 “향후 객관적 데이터를 기반으로 글로벌 제약사와 파트너들에게 더 적극적으로 기술수출을 타진할 것”이라고 말했다.
한편, 업계에 따르면 글로벌 c-MET 표적 치료제 시장 규모는 약 6조원 수준으로 집계된다. 연평균 시장 성장률은 20%에 달하는 만큼 시장 전망은 매우 긍정적이다.






![압타머사이언스 ‘AST-201’ IRB 통과 소식에 上…펩트론, IR 기대감에 주가 ‘들썩’[바이오 맥짚기]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24111800058b.jpg)


