팜이데일리 프리미엄 기사를 무단 전재·유포하는 행위는 불법이며 형사 처벌 대상입니다.
이에 대해 팜이데일리는 무관용 원칙을 적용해 강력히 대응합니다.
[이데일리 석지헌 기자] 4세대 대사항암제 외에
뉴지랩파마(214870)가 주력하고 있는 파이프라인은 표적항암제 ‘탈레트렉티닙’이다. 비소세포성 폐암 치료제인 이 약물은 현재 미국·한국·중국·일본에서 글로벌 임상2상 중이다. 회사는 지난 6월 중국과 일본 임상2상 중간 데이터 결과를 공개한 데 이어 국내에서 진행한 임상2상 중간 데이터도 발표했다.
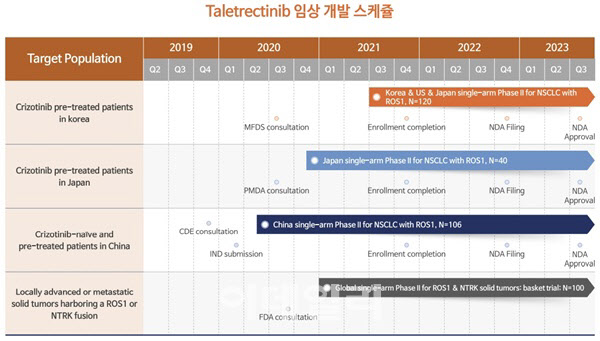 | | 비소세포성 폐암 치료제 ‘탈레트렉티닙’ 임상 개발 일정표.(자료= 뉴지랩파마) |
|
국내 임상 중간 데이터에 따르면 2차 치료제군 중 6주 이상 투약을 지속한 환자 4명 중 3명에게서 암이 30% 이상 소멸된 소견인 ‘부분관해(Partial Response)’가 나타났다. 이에 따라 객관적 반응률(ORR)은 75%로, 앞서 지난 6월 중국과 일본 임상 결과보다 우수하다. 이번 부분관해가 관찰된 2차 치료제군은 암 확진 판정 이후 기존 표준 치료제인 화이자 ‘잴코리’를 투약했으나 내성이 생긴 환자들을 모집한 그룹이다.
앞서 지난 6월 미국임상종양학회(ASCO)에서 공개된 중국·일본 임상2상 중간 데이터에서는 1차 치료제군 ORR이 92.5%, 2차 치료제군 ORR은 50%로 각각 나타났다.
임재석 뉴지랩파마 사장은 이번 국내 임상 결과에 대해 “2차 치료제군은 1차 치료제군과 비교할 때 암의 진행 속도가 빠르고, 정상치보다 많이 저하된 상태에서 진행한다”며 “충분한 치료 효과를 발휘하기 어려운 상황에서도 환자 75%에서 약효가 관찰된 것은 그만큼 약효가 뛰어난 것으로 해석된다. 1차 치료제군에 대한 환자는 현재 스크리닝 작업 중인데, 투약 시 완전관해도 기대된다”고 말했다.
탈레트렉티닙 중국 임상은 이노벤트 바이오가 진행 중이며 한국 임상을 뉴지랩파마가 맡았다. 미국과 일본 임상은 아노트테라퓨틱스가 진행한다. 현재 한국·미국·일본에서 비소세포성폐암 ROS-1 변이 환자 120명을 대상으로 임상2상 임상시험계획서(IND)를 승인받았으며, 전체 목표 환자의 30% 가량 모집을 끝냈다. 올해 환자 등록을 모두 마친다는 목표다. 뉴지랩파마는 내년 2분기까지 탈레트렉티닙 임상시험을 마치고 미국과 일본, 한국에서 조건부 사용 승인을 신청한다는 계획이다.
이밖에도 회사는 당뇨복합제 ‘NGL-101’과 먹는 코로나19 치료제 ‘뉴젠나파모스타트정’을 개발 중이다.
‘NGL-101’은 기존 당뇨병 치료제인 ‘다파글리플로진’과 ‘시타글립틴’을 하나로 합친 개량신약으로 1상만 마치면 신약허가가 가능하다는 설명이다. 현재 1상 임상시험에서 환자 투약을 완료하고 결과를 분석하고 있다.
경구용 코로나19 치료제 ‘뉴젠나파모스타트정’은 현재 따로 임상을 진행하고 있지는 않으나, 향후 코로나 진행 상황에 따라 임상 진행 여부를 결정한다는 방침이다.
뉴지랩파마는 늦어도 2024년부터 파이프라인 상업화에 따른 매출이 발생할 것으로 기대하고 있다. 탈레트렉티닙과 당뇨복합제인 NGL-101의 신약허가 취득 시기가 모두 내년 하반기로 예상돼 두 가지 파이프라인에서 매출이 발생할 수 있다는 설명이다.
임 사장은 “탈레트렉티닙 경쟁 약물인 잴코리 국내 매출액은 약 500억원으로 파악된다. 탈레트렉티닙은 잴코리 내성 환자까지 포함한 1,2차 치료제를 동시에 허가받는 것을 계획하고 있기 때문에 잴코리의 국내 매출액 이상 달성할 수 있을 것으로 예상하고 있다”고 밝혔다.
이어 “당뇨복합제인 NGL-101이 타겟하고 있는 당뇨병은 전세계적으로 130조원, 국내에서는 6000억원 시장 규모를 형성하고 있는 만큼, 국내에서 매출 300억원을 달성할 계획”이라고 말했다.











