[이데일리 송영두 기자] 10여년 전에는 상대가 되지 않았던 중국의 신약 바이오 기술력이 무섭게 성장하고 있다. 지난해 신약 품목허가 제품 수는 한국과 24배 차이가 났고, 올해 1분기 기술이전 규모도 한국의 20배에 달하는 것으로 나타났다.
2일 한국바이오협회 바이오경제연구센터가 중국 국가의약품감독관리국(NMPA) 보고서를 인용한 리포트에 따르면 중국은 20204년 48개의 퍼스트 인 클래스(First in Class) 혁신 신약과 다수 소아 및 희귀질환 치료제를 시판 허가했다.
지난해 허가받은 신약은 항암제, 신경계 질환 및 항감염제 등 약 20개 분야 치료제로, 2022년 21건, 2023년 40건에 비해 증가했다. 특히 지난 5년간 가장 많은 허가 건수를 기록했다. 올해 허가받은 혁신 신약 중 17개는 우선 심사를 통해 승인을 받았고, 11개는 조건부 승인을 받았다. 임상 중인 의약품 중에서도 획기적 치료제로 13개가 허가된 것으로 나타났다.
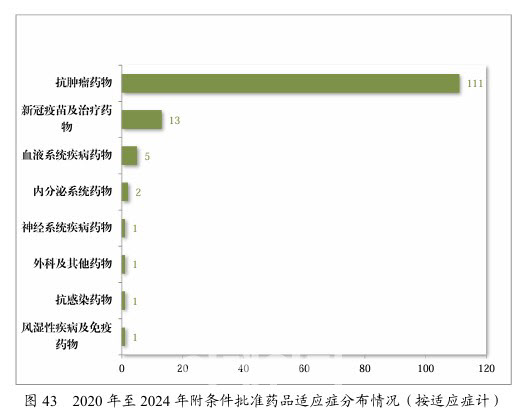 | | 2020년부터 2024년까지 중국 국가의약품감독관리국(NMPA) 조건부 승인 의약품의 적응증 분포 현황.(자료=NMPA) |
|
중국이 2020년 의약품 등록 및 관리 규정을 업데이트한 후 496건의 의약품 승인 신청을 우선 심사 프로그램에 등록했고, 이 중 42.54%가 항암제였다. NMPA 약물평가센터 관계자는 ”중국 정부는, 의약품 승인을 가속화하기 위해 4개의 가속화 경로를 마련했다“며 “우선 심사 승인 경로에는 긴급한 수요가 있는 의약품, 주요 감염병 및 희귀질환을 치료하는 의약품, 업그레이드된 신약 및 소아용 의약품, 혁신적인 백신이 포함된다”고 말했다.
우선 심사 경로를 통하면 허가 표준 검토 시간이 200일에서 130일로 단축되고, 긴급 임상 수요를 충족해 해외 승인을 받은 의약품의 경우 검토 기간이 70일로 더욱 단축된다.
반면 한국의 경우 지난해 기준 식품의약품안전처가 품목허가한 신약은 총 24개였다. 하지만 이중 국내 기업이 자체 개발한 국산 신약은 2개에 불과했다. 지난해 4월 제일약품(271980) 자회사 온코닉테라퓨틱스가 개발한 위식도역류질환 치료제 자큐보가 국산 37호 신약으로 허가받았다. 12월에는 비보존제약이 개발한 비마약성진통제 어나프라주가 국산 38호 신약으로 허가받았다.
중국의 신약허가 개수와는 24배 차이가 난다. 비단 신약 허가 개수에서만 큰 차이가 나는 것이 아닌 기술이전 규모에서도 유사한 차이가 났다.
중국 데이터플랫폼 넥스트파마에 따르면 올해 1분기 중국 바이오 기술이전 규모는 369억2900만 달러로 나타났다. 이는 지난해 중국 전체 기술이전 규모의 약 70%에 달하는 수치로, 폭발적인 성장세를 기록했다.
한국제약바이오협회에 따르면 2021년만 하더라도 기술이전 규모에서 한국은 109억 달러로 138억 달러의 중국과 비슷한 양상을 보였다. 하지만 2022년부터 2024년까지 한국 기술이전 규모는 48억 달러, 59억 달러, 55억 달러에 그쳤다. 규모가 증가하지 못하고 오히려 축소됐다. 반면 중국은 2022년 285억 달러로 1년만에 107% 증가했고, 2023년에는 412억 달러, 지난해에는 522억 달러로 급증했다.
기술수출 규모만 성장한 것이 아니라 질도 좋아졌다. 글로벌 제약사가 기술도입한 3건 중 1건이 중국 기업의 후보물질인 것으로 나타났다.
국내 바이오 기업 대표는 “과거 10여년 전만하더라도 국내 제약바이오 기업 종사자들이 중국 기업과 기술에 대해 큰 경쟁심을 느끼지 않았다. 소위 얕잡아 봤었다”면서 “하지만 지금은 완전히 달라졌다. 한국보다 기술수출 횟수와 규모가 훨씬 클 뿐 아니라, 신약 허가에서도 큰 차이가 있다. 이는 중국 정부는 물론 지방 도시 단위의 투자가 폭발적으로 증가했기 때문이다. 한국도 민간 기업과 함께 정부가 경각심을 갖고 경쟁력읠 갖추기 위한 제도와 지원 체계를 마련해야 한다”고 말했다.






![엘앤씨바이오, 中 유방재건·관절염 시장 공략 본격화[인베스트 바이오]](https://image.edaily.co.kr/images/vision/files/NP/S/2025/08/PS25083100062b.jpg)
![[바이오맥짚기] 현대ADM·현대바이오, 주가 동반 상승...네오이뮨텍도 급등](https://image.edaily.co.kr/images/vision/files/NP/S/2025/08/PS25082900216b.jpg)

![中바이오기업, 美생물보안법안 로비는 현재진행형[제약·바이오 해외토픽]](https://image.edaily.co.kr/images/vision/files/NP/S/2025/08/PS25083000147b.jpg)