2022년 한 해 동안 진행됐던 ‘블록버스터 톺아보기 파트1’은 3년 전인 2020년 세계에서 가장 많이 팔린 의약품 1~55위를 차례로 다뤘다. ‘블록버스터 톺아보기 파트2’는 2022년~2023년 사이 새롭게 10억 달러 이상 매출을 올렸거나 3~4년 내로 그에 상응하는 매출을 올릴 것으로 예상되는 약물을 하나씩 발굴해 다룬다. 이른바 신흥 블록버스터로 떠오른 약물의 탄생과정과 매출 전망 등을 두루 살펴본다.[편집자 주] 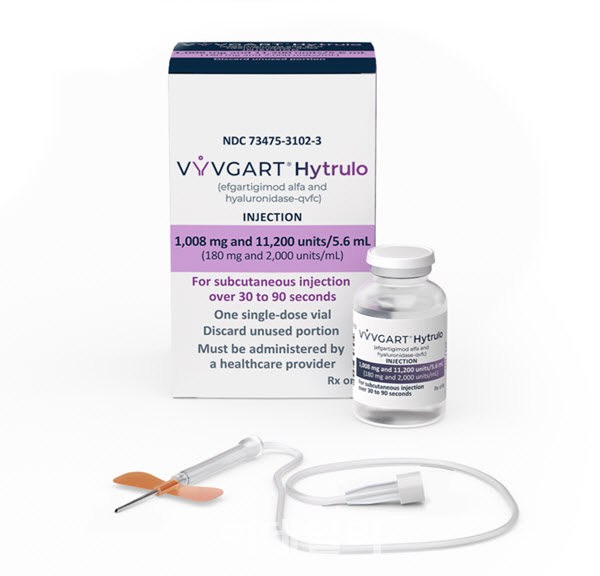 | | 네덜란드 아르겐엑스가 피하주사(SC)제형으로 개발한 전신성 중증 근무력증 치료제 ‘바이브가트 하이트룰로’(성분명 에프가티지모드 알파+히알루로니다제).(제공=아르젠엑스) |
|
[이데일리 김진호 기자]네덜란드 아르겐엑스가 피하주사(SC)제형으로 개발한 전신성 중증 근무력증 치료제 ‘바이브가트 하이트룰로’(성분명 에프가티지모드 알파+히알루로니다제)가 적응증을 추가하며 매출 신장을 노리고 있다.
바이브가트 하이트룰로는 인간 면역글로불린 G1 항체를 이루는 단백질이며, 미국 할로자임의 인간히알루로니다제 기술을통해 정맥주사(IV)에서 SC로 제형 변경에 성공한 약물이다. 해당 약물은 4주동안 주1회씩 30~90초 피하에 주입하게 된다.
지난해 6월 미국 식품의약국(FDA)가 항아세틸콜린 수용체 항체 양성 전신 중증 근무력증 치료제로 처음 승인된 바이브가트 하이트룰로를 승인했다. 항아세틸콜린 수용체 항체 양성을 띠는 전신 중증 근무력증 환자는 해당 질환을 앓고 있는 환자의 85%로 알려졌다.
아르겐엑스에 따르면 기존 제품인 바이브가트와 바이브가트 하이트룰로 등 2종 제품의 합산 매출은 매출 12억 달러(한화 약 1조 6500억원)를 기록했다. 바이브가트 하이트룰로가 바이브가트를 대체하고 있으며, 적응증 및 출시국 확대 절차도 순조롭게 진행 중이라는 설명이다.
우선 유럽의약품청(EMA)도 FDA가 승인한 첫 적응증에 대해 바이브가트 하이트룰로의 허가 심사 작업을 진행하고 있으며, 연내 그 결론이 나올 예정이다.
이에 더해 지난 21일(현지시간) FDA가 바이브가트 하이트룰로를 만성 염증성 탈수초성 다발성 신경병증(CIDP) 환자에게 쓸 수 있도록 적응증을 추가로 승인했다. 미국에서 지난 2월 해당 적응증의 심속 심사에 착수한 지 4개월만에 내려진 결론이었다.
CIDP는 말초 신경계에서 드물게 나타나는 신경근 장애의 일종이며, 이동성 장애, 감각계 이상 등 증상이 서서히 진행되지만 파괴적인 상태에까지 이를 수 있는 것으로 알려졌다.
뤽 트뤼옌 아르겐엑스 최고의학책임자(CMO)는 트뤼옌 최고 의학책임자는 뒤이어 “CIDP 환자에게 30여 년 만에 혁신적인 치료 대안을 확보하게 된 것이다”며 “신생 Fc 수용체의 차단이 면역글로불린 매개 자가면역성 질환들을 치료하는 데 유용하게 적용될 수 있을 것으로 기대한다”고 말했다.






![알테오젠, 일시적 투심하락 관망세 전환…삼양바이오팜 가파른 상승[바이오맥짚기]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/01/PS26012300239b.jpg)


