[이데일리 김새미 기자] 지아이셀은 자사의 동종유래 자연살해(NK)세포치료제인 ‘T.O.P. NK’과
지아이이노베이션(358570)의 면역항암제인 ‘GI-101A’의 병용 임상 1/2a상 임상시험신청서(IND)를 식품의약품안전처에 제출했다고 2일 밝혔다.
 | | 지아이셀 GMP 시설 (사진=지아이셀) |
|
지아이셀은 지아이이노베이션의 관계사다. 양사는 향후 추가 협업을 통해 T.O.P. NK와 ‘GI-102’의 병용요법 임상도 돌입할 예정이다.
회사에 따르면 T.O.P. NK는 대량 배양이 가능하고 종양 타깃능과 암세포 살상효율을 극대화한 차세대 NK세포치료제다. 현재 재발성·불응성 고형암과 혈액암 환자를 대상으로 진행 중인 단독요법 임상 1상에서 우수한 효능을 보였다.
GI-101A는 ‘CD80’과 ‘IL-2 변이체’ 기능을 동시에 가진 이중융합단백질이다. IL-2 부위는 면역세포의 증식·활성화에 관여하고, CD80은 암세포를 공격하는 면역세포를 억제하는 수용체인 CTLA4를 차단하는 역할을 한다. 현재 면역항암제 키트루다와 병용요법으로 국내와 미국에서 임상 1/2상 진행 중이다.
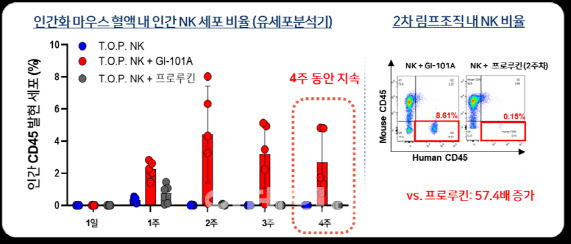 | | GI-101 병용투여에 따른 T.O.P. NK의 체내지속성 증가 (자료=지아이셀) |
|
양사는 인간화 마우스를 이용한 비임상 시험에서 GI-101A 또는 GI-102와 T.O.P. NK의 병용투여 시 T.O.P. NK의 체내 지속성이 1개월간 유지되고 T.O.P. NK 단독투여 대비 항암효능이 월등히 증가하는 것을 확인했다. 지아이셀은 이러한 결과를 바탕으로 GI-101A, GI-102와의 병용요법에서 T.O.P. NK의 투여 용량을 단독요법 대비 수배에서 수십배 낮춤으로써 생산원가를 줄여 상업성을 극대화할 것으로 기대하고 있다.
지아이셀은 임상용 NK 세포치료제의 원활한 생산을 위해 자체적인 1000평 규모의 의약품제조·품질관리기준(GMP) 시설을 갖추고 있다. 해당 시설은 첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률(첨생법)에서 규정하는 허가 3종인 첨단바이오의약품 제조업 허가, 인체세포 등 관리업 허가, 세포처리시설 허가를 모두 취득했다.
장명호 지아이셀 최고임상과학고문은 “최근 첨생법 개정안의 국회 본회의 통과로 말기암 환자뿐만 아니라 초기암과 수술 후 환자들도 세포·유전자 치료를 받을 길이 열렸다”라며 “GI-101A, GI-102와 T.O.P. NK의 병용요법의 개발을 통해 더 많은 환자들이 혜택을 보도록 하겠다”고 말했다.







![냉탕 온탕 오간 에이프릴바이오…실적 호조에 로킷·휴젤 상승[바이오맥짚기]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/02/PS26021200275b.jpg)


