[이데일리 김진호 기자]“생체 내에서 이상 단백질이 서로 엉키면서 응집체를 이룬 다음 규칙적 구조로 섬유화된 것을 통틀어 ‘아밀로이드 피브릴’이라고 합니다. 이는 당뇨부터 치매, 파킨슨병 등 다양한 질환을 일으키는 원인이지만, 수백만 개 이상의 단백질이 연결돼 있어, 원자 수준에서 명확한 구조를 파악하기 어려웠습니다.”
이영호 한국기초과학지원연구원(KBSI)바이오융합연구부 책임연구원은 21일 이데일리와 만나 “한국 연구진 최초로 당뇨병과 관계된 ‘글루카곤 아밀로이드 피브릴’의 원자 구조를 규명하는 데 성공했다. 새로운 기전을 바탕으로 한 신약 후보물질 발굴의 이정표가 될 것이라고 본다”며 이같이 말했다.
 | | 이영호 한국기초과학지원연구원(KBSI) 책임연구원이 이끄는 연구진이 국내 최초로 당뇨병과 관련된 이상 단백질 응집체 중 ‘글루카콘 아밀로이드 피브릴’의 구조를 원자수준에서 규명하는데 성공했다.(제공=이영호) |
|
21일(현지시간) 이 책임연구원이 이끄는 KBSI 연구진은 오픈 액세스 저널 ‘바이오아카이브’(bioRxiv)에 글루카곤 아밀로이드 피브릴의 원자 구조를 밝힌 연구 결과를 발표했다. 미국과 중국 등에 이어, 한국 연구진으로서는 최초로 아밀로이드 피브릴의 구조를 밝힌 연구 논문이다.
일반적으로 단백질의 구조를 실험적으로 밝히려면 짧으면 수개월에서 수년 이상 소요된다. 최근 구글 자회사 딥마인드가 내놓은 알파폴드2와 같은 단백질 구조예측 인공지능(AI) 기술이 발달했지만, 이런 AI가 밝힌 단백질 구조 역시 실제 신약 개발 등에 활용되려면, 실험적으로 특성과 생체 내 상호작용을 검증하는 작업이 필요한 상황이다.
그러나 생체 내에는 단백질이 뭉친 응집체, 즉 아밀로이드 피브릴들이 곳곳에 존재한다. 췌장 인근에서 혈당을 조절하는 호르몬인 글루카곤, 인슐린, 아밀린 등이 서로 뭉쳐 아밀로이드 피브릴을 형성하면, 그 기능을 제대로 수행하지 못하게 된다. 이번에 KBSI 연구진이 규명한 글루카곤 아밀로이드 피브릴이 그중 하나다.
이 책임연구원은 “노화나 스트레스 등으로 생체 내 곳곳에서 단백질 응집 현상이 일어난다. 수백만 개 이상의 이상의 글루카곤이 뭉친 ‘글루카곤 아밀로이드 피브릴’은 글루카곤이 적상적으로 작동하지 못 하게 한다”고 설명했다. 최근에 개발된 ‘글루카곤 작용제’(GCG)나 ‘글루카곤 유사 펩타이드’(GLP) 계열의 약물도 체내에서 이런 응집 현상을 일으켜 활성을 잃을 수 있는 셈이다.
그에 따르면 수백만 개의 단백질이 뭉친 아밀로이드 피브릴의 구조를 밝히는 것은 단백질 연구자들도 한동안 기피해 온 분야였다. 하지만 극저온전자현미경(Cryo-EM) 및 X선 크리스탈로그래피(결정학), 핵자기공명(NMR) 등 생체 분자 분석 기술의 발달에 힘입어 실험적으로 이를 측정하려는 시도가 활발해지고 있다.
연구진이 Cryo-EM 장비 등의 분석기법을 활용해 최초로 글루카곤 아밀로이드 피브릴의 구조를 밝히는데 약 3년 반의 시간이 걸렸다. 이 책임연구원은 “글루카곤 아밀로이드 피브릴도 무수한 종류가 있을 수 있습니다. 그 중에 하나를 밝히는데 처음이라 시간이 꽤 걸렸고, 이는 계속 단축돼 갈 것”이라며 “이런 데이터가 쌓이면 신개념 당뇨병 치료제를 개발할 수 있을 것”이라고 전망했다. 이런 연구를 바탕으로 현재 개발된 GLP나 GCG 계열의 당뇨병 치료제가 아밀로이드 피브릴을 형성하지 않도록 개선하면 투약 간격을 늘리거나 부작용을 줄이는 약물을 설계할 수 있다는 것이다.
그는 이어 “아밀로이드 피브릴의 구조를 밝히려는 경쟁이 최근 들어 더 치열해지고다. 이번 바이오아카이브에 선제적으로 연구 결과를 올려, 국내에서 해당 능력을 보유한 것을 처음으로 증명했다”며 “해당 논문을 국제학술지인 ‘네이처’나 ‘사이언스’ 등에 게재하기 위해 논문을 추가로 준비하고 있다”고 덧붙였다.
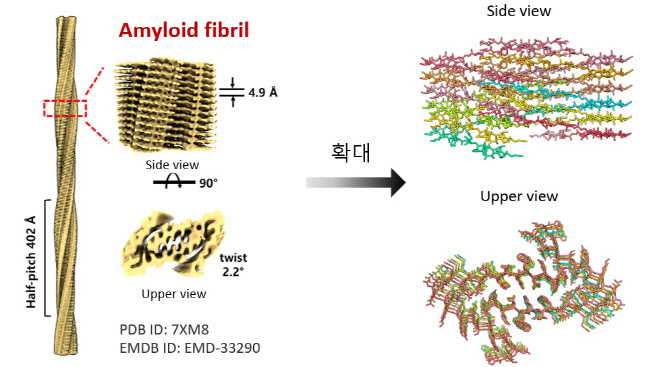 | | 다양한 요인에 의해 체내 혈당량을 조절하는 호르몬인 글루카곤이 이상 단백질로 바뀌게 된다. 이런 이상 단백질이 수백만 개 이상 규직적으로 뭉친 것이 ‘글루카곤 아밀로이드 피브릴’(왼쪽)이며, 그 모양도 천차만별이다. 오른쪽은 이영호 한국기초과학지원연구원(KBSI) 책임연구원이 밝힌 글루카곤 아밀로이드 피브릴의 원자 구조의 단면을 형상화한 모습이다.(제공=이영호) |
|
연구진은 현재 치매를 유발하는 아밀로이드 피브릴의 구조도 밝히는 중이다. 이 책임연구원은 “치매, 파킨슨병, 광우병 등도 이상 단백질의 응집으로 인한 질병들이다”며 “다양한 아밀로이드 피브릴의 구조를 밝혀 관련 질환을 치료할 신약 후보물질을 찾는 후속 연구를 진행해 나갈 것”이라고 말했다.
이 밖에도 연구진은 국내 당단백질 분석 및 AI 개발 전문 바이오벤처 ‘셀키’(Cellkey)와 함께 아밀로이드 피브릴 분석용 AI 알고리즘 관련 개발 작업도 준비하고 있다.
그는 이어 “알파폴드2와 같은 단백질 구조예측 AI의 수준에서는 아밀로이드 피브릴의 구조를 예측하기 어렵다”며 “우리가 확인한 아밀로이드 피브릴의 실험적 데이터를 학습한 AI 개발을 위한 협업도 진행하고 있다. 수년 내로 각 질환 분야에서 아밀로이드 피브릴을 활용한 신약개발을 하는 시대가 도래하게 될 것”이라고 덧붙였다.
한편 글루카곤 아밀로이드 피브릴의 구조를 원자 수준에서 규명한 이번 연구는 과학기술정보통신부 산하 출연 연구기관을 관리하는 국가과학기술연구회(NST)가 지원하는 다학제 융합클러스터 연구개발 사업의 일환으로 진행됐다.
◇이영호 한국기초과학지원연구원(KBSI) 책임연구원은...
△2008년 일본 오사카대 단백질연구소 고분자학과 박사학위 취득 △2008~2010년 일본 오사카대 단백질연구소 박사후연구원 △ 2010~2018년 오사카대 단백질연구소 부교수 △2018년~현재 KBSI 책임연구원 △2019년~현재 과학기술연합대학원대학교(UST) 부교수 △2020년~현재 충남대학교 부교수







!['2% 로열티'가 무너뜨린 신뢰…알테오젠發 바이오株 동반 하락[바이오맥짚기]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/01/PS26012201091b.jpg)


