[이데일리 나은경 기자] 줄기세포치료제 개발사 코아스템켐온(166480)은 루게릭병(ALS) 치료제 ‘뉴로나타 알’의 임상 3상 후속 분석 결과, 특정 환자군에서 환자의 기능 상태를 나타내는 ALSFRS-R 점수가 통계적으로 유의하게 개선되고 신경손상 바이오마커인 NfL 수치가 유의미하게 감소하는 것을 새롭게 확인했다고 10일 밝혔다.
회사 관계자는 “이번 분석 결과는 뉴로나타 알의 임상적 유의성이 한층 더 확보되었음을 의미한다”며 “해당 치료제가 미국 FDA의 가속 승인을 받을 가능성을 크게 높여주는 주요 근거로 평가된다”고 말했다.
미국 식품의약국(FDA)의 가속 승인(Accelerated Approval) 제도는 치료제 개발에 있어 치료제가 없는 중증 질환을 대상으로, 최종 임상 결과를 기다리지 않더라도 의미 있는 대리 지표(Surrogate Endpoint)의 개선을 입증하면 조기 승인을 받을 수 있게 한 절차다. 루게릭병처럼 미충족 의료 수요가 큰 질환에서는 신뢰도 높은 바이오마커의 변화만으로도 승인이 이뤄진 사례가 있어 코아스템켐온은 일찍부터 바이오마커 기반의 가속 승인 전략을 구체화해왔다.
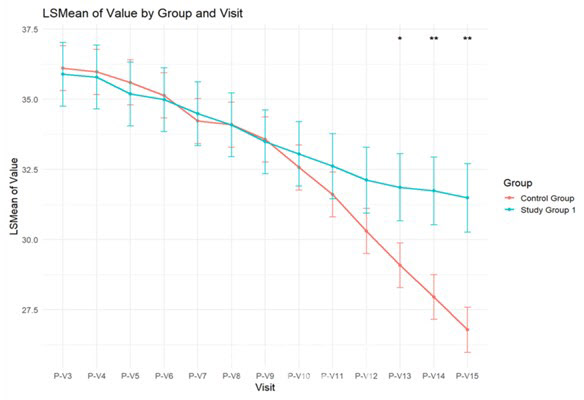 | | 뉴로나타 알 임상 3상 시험군 1과 대조군 간 저속 진행군의 ALSFRS-R 점수 변화 (자료=코아스템켐온) |
|
이번 임상 3상 추가 분석에서는 시험 치료제 투여 횟수에 따른 두 환자군(2회 투여군, 5회 투여군)의 데이터를 바탕으로, 질병 진행 속도에 따라 환자를 저속 진행군(Slow Progressor)과 고속 진행군(Fast Progressor)으로 구분해 결과를 살폈다. 그 결과 두 투여군 모두 질병 진행이 저속 진행군에서 위약 대비 두드러진 개선 효과가 관찰됐다. 특히 ALSFRS-R 점수의 경우, 5회 투여군에서는 치료 시작 9개월 시점부터 개선이 나타나 2회 투여군의 10개월 시점보다 한 달 일찍 통계적으로 유의한 차이를 보였다.
같은 기간 해당 환자들의 NfL 수치도 치료군에서 현저한 감소 추세를 나타내며, 추가 투여에 따른 치료 효과가 바이오마커로도 반영됐다.
신경손상 바이오마커인 NfL 분석 결과 역시 일관된 개선 양상을 보였다. 시험약 2회 및 5회 투여군 모두에서 치료 후 NfL 수치가 전반적으로 감소했으며, 특히 5회 투여군에서는 투여 4개월째와 10개월째에 대조군 대비 NfL 수치가 유의미하게 낮은 수준(각 시점 p<0.05)을 나타냈다. 환자군을 세부적으로 비교한 결과 이러한 NfL 감소 효과는 저속 진행 환자군에서 더욱 두드러지게 나타나, 뉴로나타 알이 질병 진행 속도가 완만한 환자에서 보다 임상지표 개선을 이끌어낼 수 있음을 시사한다.
NfL은 신경퇴행성 질환의 진행 정도를 반영하는 핵심 바이오마커로, 바이오젠의 루게릭병 치료제 ‘토퍼센’이 이 지표를 바탕으로 FDA 가속 승인을 받은 바 있다. 이번 뉴로나타 알의 분석에서도 동일 지표인 NfL 수치가 통계적으로 유의하게 감소했으며, 이는 임상적 개선과 더불어 FDA 승인 기준과의 정합성을 확보하고 있다는 점에서 전략적으로 큰 의미를 지닌다.
코아스템켐온 관계자는 “앞서 MCP-1과 임상 지표 간 상관관계를 일부 확인한 데 이어, 이번 분석에서도 ALSFRS-R과 NfL에서 유의미한 개선이 관찰됐다”며 “이를 기반으로 글로벌 CRO와 최종 임상보고서(CSR)를 준비 중”이라고 밝혔다.
이어 “뉴로나타-알은 FDA가 토퍼센 승인에 활용한 과학적 기준과 유사한 임상 지표를 충족해가고 있으며, 이번 결과는 가속 승인 가능성을 높여주는 중요한 근거가 될 것”이라고 덧붙였다.







!['2% 로열티'가 무너뜨린 신뢰…알테오젠發 바이오株 동반 하락[바이오맥짚기]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/01/PS26012201091b.jpg)

