[이데일리 김유림 기자] 알츠하이머 신약 개발 현황을 분석한 결과 글로벌 빅파마와 국내 바이오텍이 상당한 차이를 보였다. 빅파마는 알츠하이머 증상 초기 단계 환자에 집중하고 있는 반면 한국 바이오텍은 경증부터 중증을 타깃으로 개발하고 있는 것으로 나타났다.
 | | [표=김유림 기자] |
|
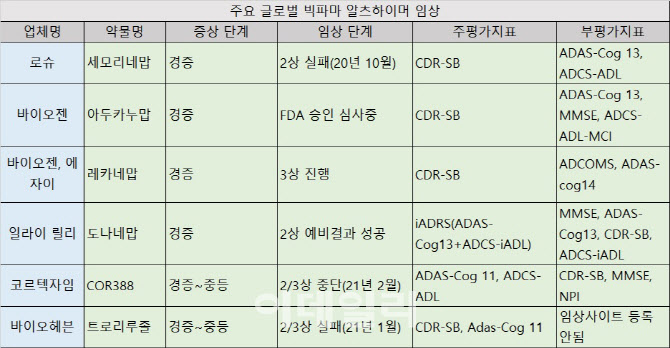
알츠하이머 치료제는 글로벌 빅파마가 자본력과 기술력으로 도전을 이어갔지만, 2003년 미국 식품의약국(FDA) 승인을 받은 메만틴 이후 나오지 않고 있다. 도네페질, 리바스티그민, 갈란타민, 메만틴 등 단 4개에 불과하다.
최근 글로벌 빅파마의 알츠하이머 개발 동향을 살펴보면 경증(mild)에 집중하고 있는 분위기다. 바이오젠 아두카누맙, 바이오젠과 에자이 레카네맙, 일라이릴리 도나네맙 등은 경증 환자를 대상으로 임상을 진행하고 있다.
이 중 아두카누맙은 오는 7일 미국 식품의약국(FDA) 승인 여부가 결정된다. 바이오젠은 초기 단계의 알츠하이머 환자를 대상으로 임상 3상을 수행했으며, 1차평가 지표인 치매평가척도 CDR-SB에서 위약군 대비 22% 개선된 결과를 보였다.
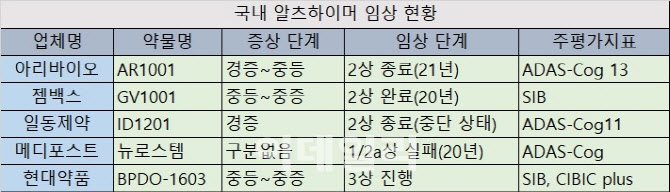
한국 개발사 중에서는 경증만 타깃으로 하는 기업은 없다. 아리바이오 AR1001은 글로벌 2상을 종료했으며, 알츠하이머 경증에서 중등 환자를 대상으로 임상을 진행했다.
젬백스(082270)는 국내 임상 2상을 완료, 중등에서 중증 환자를 타깃으로 했다.
현대약품(004310) BPDO-1603 역시 중등에서 중증을 타깃으로 국내 임상 3상을 진행 중이다.
바이오회사 임원은 “코로나 백신도 1년 만에 내놓을 만큼 과학이 발전했지만, 알츠하이머는 가설만 있을뿐 정확한 원인을 규명하지 못했다. 수십년전부터 개발에 뛰어든 빅파마들이 경증부터 중등증, 중증 모두 개발에 실패하면서, 초기 증상에 집중하는 방향으로 가고 있다. 경증 환자수가 70%가량으로 제일 많이 차지하고 있으며, 조기 관리 치료제 개발이 트렌드다”고 설명했다. 이어 “국내는 아직 알츠하이머 신약 개발 역사가 오래되지 않아 경증에만 그치지 않고, 중등, 중증 전부 해보고 있는 것으로 분석된다”고 덧붙였다.
 | | [표=김유림 기자] |
|
글로벌 빅파마는 경증 타깃 임상에서 1차지표로 CDR-SB를 활용하는 공통점을 보였다. CDR-SB는 인지와 기능을 모두 평가할 수 있는 검사이며, 경증에서도 예민하게 약물의 효과를 반영한다. FDA는 2013년 알츠하이머 초기 치료후보물질의 효능평가에 CDR-SB 사용을 권장했다.
다만 FDA가 2018년 다시 한번 발표한 경증 치료제 가이드라인에서는 신경심리검사 혹은 복합적인 평가도구로 측정할 것을 권장했다. 통계적 유의성 증명이 까다로운 것으로 평가받는 CDR-SB를 따르지 않아도 된다. 일라이릴리 도나네맙은 임상 2상에서 자체 개발한 iADRS을 사용했다. 인지력 손상을 나타내는 ADAS-Cog13과 환자의 일상생활 독립적 수행능력을 평가하는 ADCS-iADL을 결합, 일라이릴리가 직접 만든 평가지표다.
빅파마의 경증에서 중등, 중등에서 중증 타깃 임상에서는 1차지표로 두 가지를 사용했다. 임상에 성공해 FDA 품목허가까지 받은 메만틴은 SIB와 CIBIC plus, 갈란타민은 ADAS-cog와 CIBIC plus를 평가했다. FDA는 중등과 중증의 인지기능에 변화가 뚜렷한 만큼 환자와 간병인의 인터뷰를 통해 얻은 정보로 전반적인 임상 상태를 평가할 수 있도록 하는 CIBIC plus를 권고하고 있다.
국내 신경과학 분야의 권위자인 서유헌 서울대 명예교수는 “각 국가의 보건 당국의 임상 가이드라인이나 권고 사항이 있지만, 권고사항일뿐 의무는 아니다. 다른 평가지표를 사용해도 되며, 효능을 입증하기만 하면 된다. 다만 여러 평가지표 중에 빅파마가 사용하는 지표가 특정되고 있는데, FDA가 알츠하이머 임상에 전통적으로 원하는 평가지표가 허가에 유리하기 때문이다”고 설명했다.
중등에서 중증 타깃으로 국내 임상 3상 단계인 현대약품 BPDO-1603은 FDA 품목허가 기준으로 SIB와 CIBIC plus 두가지 모두 1차지표로 설정하고 있다. 식약처 임상 3상 신청이 반려된 젬백스 역시 1차지표를 두개로 설정한 임상디자인으로 재신청을 준비하고 있다. 아리바이오는 경증에서 중등 타깃으로 글로벌 임상 2상을 완료했으며, 3상을 준비 중이다. 2상 1차지표로 ADAS-Cog 13를 사용했다.








![냉탕 온탕 오간 에이프릴바이오…실적 호조에 로킷·휴젤 상승[바이오맥짚기]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/02/PS26021200275b.jpg)


