 | | 미프지미소 |
|
[이데일리 노희준 기자] 이르면 연내에 ‘먹는 낙태약’ 미프지미소(Mifegymiso)가 국내에서 나온다. 해외에서 이 약품을 도입해 허가 절차를 밟고 있는 국내 제약회사가 약의 조기 도입을 위해 당국과 인종간 약의 차이를 검토하는 가교임상을 생략하는 방안을 협의하고 있는 것으로 나타났다.
8일 식품의약품안전처에 따르면, 현대약품은 임신중단 약물(유산 유도제) ‘미프지미소’의 품목허가를 신청하면서 가교임상을 제외해달라고 했다. 식약처 관계자는 “현대약품이 가교임상을 생략하는 방안으로 검토를 요청했다”며 “가교임상 생략은 확정되지 않았지만, 생략 방안의 타당성을 검토 중”이라고 말했다.
가교임상(브릿지 스터디)은 외국에서 개발된 신약의 인종간 차이에 따른 영향을 확인하기 위해 내국인을 상대로 실시하는 임상시험을 말한다. 대개 해외 개발 신약은 외국인을 대상으로만 임상을 거쳐 약의 유효성과 안전성이 검증되기 때문이다. 국내 도입된 적이 없는 신약은 원래 가교임상을 하는 게 원칙이다. 다만, 자료 등을 거쳐 합당한 사유가 있으면 당국 확인을 거쳐 생략할 수 있다.
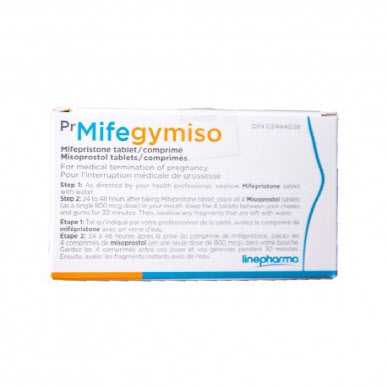
미프지미소는 국내에는 처음 도입되는 경구용 유산 유도제다. 호주, 캐나다 등에서 합법적 약물로 사용되고 있고 세계보건기구(WHO)도 필수의약품으로 지정한 약이지만, 국내에서는 낙태죄의 문턱을 넘지 못했다. 이 때문에 그간 인터넷 등을 중심으로 음성적으로만 유통돼왔다. 그러다 2019년 헌법재판소의 낙태죄 헌법불합치 결정으로 정식 허가될 수 있는 길이 열렸다.
현대약품은 지난 3월 영국 제약사 라인파마 인터내셔널과 미프지미소의 국내 판권 및 독점 공급 계약을 체결했다. 임신중단 약물의 온라인 불법 유통으로 인한 여성 피해를 줄이고 전문가 상담을 통해 안전하게 사용될 수 있는 길을 열기 위해서다. 식약처는 원래 회사측 조기 신청을 전제로 상반기까지 허가 결정을 목표로 삼았다. 하지만 회사 허가 신청 자체가 예상보다 늦어져 지난 2일에야 이뤄졌다.
식약처 관계자는 “현재 허가 처리 기한은 11월달로 돼 있지만 부족한 자료가 있는 거 같아 보완 요청을 할 예정”이라며 “보완자료가 들어오면 신속하게 처리할 예정이라 자료 보완이 잘 되면 연내 출시도 가능할 것 같다”고 말했다. 회사의 자료 보완 기간은 처리 기한에 포함되지 않는다.
미프지미소는 대중적으로 좀더 알려진 임신중절약물 ‘미프진’(Mifegyne)과는 다른 제품이다. 한때 미프진의 국내 브랜드명이 미프지미소로 알려졌지만 이는 잘못된 정보다. 미프진은 미페프리스톤 단일성분의 정제만으로 구성된 제품이다. 반면 미프지미소는 미페프리스톤 200mg 1정과 미소프로스톨 200㎍(마이크로그램, 1㎍ = 0.001mg) 4정으로 구성된 콤비팩 제품이다. 미페프리스톤을 먼저 먹은 뒤 2~3일 뒤에 미소프로스톨을 먹으면 된다.







![알테오젠, 일시적 투심하락 관망세 전환…삼양바이오팜 가파른 상승[바이오맥짚기]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/01/PS26012300239b.jpg)

