[이데일리 김유림 기자]
에스티팜(237690)이 올리고핵산치료제 원료의약품 ‘올리고’ 위탁개발생산(CDMO) 시설 증설에 열을 올리고 있다. 고객사로 추정되는 노바티스가 유럽에서 신약 허가 승인을 받으면서, 올해부터 임상 시험 원료 공급이 아닌 상업용 생산이 본격화될 것으로 전망된다.
 | | 에스티팜 반월공장. [사진=에스티팜] |
|
올리고는 ‘올리고뉴클레오타이드(oligonucleotide)’라는 화합물의 줄임말로 차세대 핵산 치료제의 원료다. 올리고 핵산 치료제는 저분자 화학합성의약품(1세대)과 항체 치료제(2세대)에 이은 제3세대 치료제로 불린다.
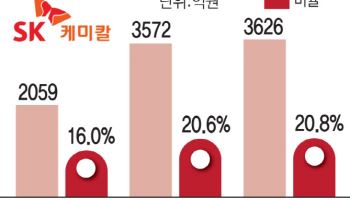
16일 금융감독원 전자공시시스템에 따르면 최근 에스티팜은 62억원 규모의 임상 3상용 올리고핵산치료제 신약 원료의약품 공급 계약을 체결했다. 계약 상대방은 미국 소재 글로벌 바이오텍회사다.
고객사는 비밀유지협약에 따라 공개되지 않았지만, 악시아 테라퓨틱스(Akcea Therapeutics)로 업계는 추측한다. 악시아는 siRNA 치료제와 함께 핵산치료제 전문 회사이며, 미국 생명공학기업 아이오니스 파마슈티컬스(Ionis Pharmaceuticals)의 자회사다.
앞서 악시아는 글로벌 빅파마에 RNA 치료제 파이프라인을 기술이전하면서 주목을 받았다. 화이자에는 심혈관 및 대사질환 파이프라인 ‘AKCEA-ANGPTL3-LRx’에 대한 전세계 독점적인 권리를 넘겼으며, 노바티스에는 심혈관질환 신약 ‘AKCEA-APO(a)-LRx’를 기술이전했다.
에스티팜의 원료를 사용하는 신약은 희귀질환으로 적응증을 확장해 2023년 판매 승인이 예상된다. 만성질환으로는 2024~2025년 상업화가 될 것으로 보고 있다. 만성질환의 글로벌 타깃환자 수가 5000만명 이상으로 추정되며, 상업용 의약품이 생산되면 수톤 규모의 올리고 원료가 필요하다.
상업용 올리고의 에스티팜 수주는 당연한 수순이다. 다른 회사 제품으로 원료를 바꿀 경우 ‘동등성시험’을 진행해야 하며 수년의 시간이 또 소요되기 때문이다. 동등성시험은 같은 성분을 함유한 두 개의 의약품이 생체이용률에 있어서 통계학적으로 같다는 것을 확인하기 위해 실시하는 임상 시험 중 하나다.
에스티팜은 올해 상업용 신약에 공급하는 올리고의 대량생산에 대한 기대감이 높다. 에스티팜의 고객사로 추정되고 있는 노바티스는 지난해 12월 siRNA 기반의 세계 첫 고지혈증 치료제 인클리시란(제품명 렉비오)이 유럽의약품청(EMA) 판매 허가를 받았다.
노바티스는 독일을 시작으로 유럽 주요 국가에 인클리시란을 공급할 예정이며, 올해 2~3분기 미국식품의약국(FDA) 승인 절차도 마무리할 계획이다. 에스티팜은 지난 16일 유럽 소재 다국적 제약사와 458억원 규모의 올리고 핵산 치료제 원료 수출 계약을 체결했다고 공시했다. 노바티스 신약 초기 물량으로 추측된다.
에스티팜의 현재 올리고 API(원료의약품) 생산가능 케파(CAPA)는 800kg이며, 2022년 1600kg, 2024~2025년 2000kg까지 증설이 완료될 것으로 관측된다. 증설 완료 이후 2000kg을 풀가동 한다는 가정하에 ‘올리고 API’ 단가 2억원/1kg을 적용하면 최대 매출 4000억원, 마진률 40%를 적용하면 1600억원의 이익이 추정된다.





![이혁준 서울대병원 교수 "암환자 식단관리앱 힐리어리 예후 바꿀 첫 도구 "[전문가 인사이트]](https://image.edaily.co.kr/images/vision/files/NP/S/2025/12/PS25121100299b.jpg)
!['상장 첫날 시총 2.8조' 에임드바이오, 코스닥 다크호스 급부상 [바이오맥짚기]](https://image.edaily.co.kr/images/vision/files/NP/S/2025/12/PS25120500172b.jpg)


