[이데일리 김유림 기자] 국내 코로나19 치료제 개발 경쟁이 치열한 가운데 셋중 하나는 동일한 제네릭(복제약)을 대상으로 임상을 진행하고 있는 것으로 나타났다. 제네릭 특성상 선두주자가 코로나 치료효능으로 용도특허를 받더라도, 특허를 회피한 후발주자 진입이 난무할 것으로 전망된다.
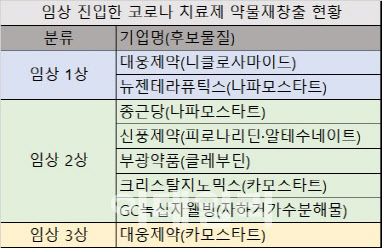 | | [자료=식약처, 표=김유림 기자] |
|
1일 식품의약품안전처에 따르면 국내 기업이 진행하고 있는 코로나19 치료제 임상시험은 총 20개다. 이 중 신약은 12개, 약물재창출 8개다. 약물재창출은 이미 시판 중이거나 임상 단계에서 실패한 약물을 활용해 다른 병증의 약물로 개발하는 방법이다.
종근당(185750)의 ‘나파모스타트’,
대웅제약(069620)의 ‘니클로사마이드’ 및 ‘카모스타트’, 뉴젠테라퓨틱스의 ‘나파모스타트’,
신풍제약(019170)의 ‘피로나리딘·알테수네이트’,
부광약품(003000)의 ‘클레부딘’,
크리스탈지노믹스(083790)의 ‘카모스타트’, GC
녹십자웰빙(234690)의 ‘자하거가수분해물’ 등 모두 8개가 약물재창출 임상 승인을 받았다.
약물재창출 성분 중에서 6개 임상이 특허권이 풀린 제네릭을 활용해 코로나19 치료제를 중복 개발 중이다. ‘나파모스트’를 대상으로 종근당이 임상 2상을, 뉴젠테라퓨틱스가 임상 1상을 각각 진행중이다. ‘카모스타트’로는 대웅제약이 임상 3상을, 크리스탈지노믹스가 임상 2상을 각자 전개하고 있다. 대웅제약이 임상 1상 중인 ‘니클로사마이드’는 씨앤팜도 임상 승인을 신청할 예정이다.
화학의약품 제네릭은 바이오의약품 복제약(바이오시밀러)과 다르게 생동성시험을 통해 수십개의 제약사가 6개월 정도면 제네릭을 쏟아낼 수 있다. 생동성시험은 의약품 복용 후 인체 흡수속도와 흡수량을 비교해 오리지널약과 제네릭이 동등함을 평가하는 시험이다.
종근당 측은 제네릭이라 할지라도 용도특허로 후발주자를 방어할 수 있다는 입장이다. 종근당 관계자는 “코로나에 효과 있는 나파모스트(제품명 나파벨탄) 최적 용량을 찾아서 식약처 허가를 가장 먼저 받은 다음 최적 용량에 대한 특허를 받으면 된다”고 강조했다. 대웅제약은 “제네릭마다 유효성은 조금씩 차이가 있는데, 자사는 다른 곳보다 뛰어난 유효성을 통해 의료현장에서 더 선호하는 약물이 될 자신이 있다”고 말했다.
‘용도특허’는 기존에 있던 물질이 치료제로서 효과가 있는 것을 발견했을 때 ‘사용처(질병)’를 인정받는 것이다. 임상 시험 선두주자가 코로나19 치료제로 제네릭 임상을 성공해 적응증을 추가, 용도특허를 받으면 출원일 기준으로 20년 동안 특허권을 보장한다.
다만 업계는 용도특허를 회피한 제네릭의 출시가 이어질 것으로 전망했다. 대형제약사 임원은 “오래전에 특허가 풀린 제네릭에 코로나 용량 특허를 걸어도 수백개 회사가 무슨 수를 써서라도 특허 회피를 할 것”이라며 “부형제를 조금 달리하거나, 폐염증 등 다른 폐질환 관련 용도 특허를 받는 방법 등으로 제네릭을 만들어 낼 수단은 무수히 많다”고 설명했다.
바이오 기업 임원은 “후발주자들이 염증 완환, 기침 완화 등 다른 적응증으로 허가를 받아 출시를 한다 해도 코로나 치료제라는 적응증으로 처방은 할 수 없다”며 “그러나 코로나에는 여러 폐 관련 증상이 많기 때문에 의사가 자체적으로 판단해 다른 적응증을 적용해 후발주자 약물을 처방하는 건 막을 수 없다”고 귀띔했다.
식약처 역시 제네릭의 중복된 임상 시험 승인을 내준 현재 상황에서 명확한 답을 내리지 못했다. 식약처 관계자는 “제네릭에 대한 허가가 나온 후 임상을 진행하는 후발주자들에 대해서는 개별 사안별로 실제로 승인이 나와봐야지 명확히 알 수 있다. 일반적으로 가정해서 답변하기 어렵다”고 말했다.







![냉탕 온탕 오간 에이프릴바이오…실적 호조에 로킷·휴젤 상승[바이오맥짚기]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/02/PS26021200275b.jpg)


