[이데일리 나은경 기자] 유한양행(000100) 자회사 에이투젠이 질염치료제 임상 2상에 돌입한다. 항생제 일변도의 질염치료제 시장에서 마이크로바이옴 신약이 게임체인저가 될 수 있을지 주목된다. 회사는 이번 임상 데이터로 기술이전에 성공하는 것을 목표로 하고 있어 중간데이터가 도출될 내년이 기업공개(IPO) 전 회사의 초기 운명을 가를 분기점이 될 전망이다.
10일 에이투젠에 따르면 전날 식품의약품안전처가 에이투젠의 주요 파이프라인인 LABTHERA-001의 임상 2a상의 임상시험계획(IND)을 승인했다. 이에 따라 회사는 오는 2026년 8월 종료를 목표로 LABTHERA-001의 안전성과 유효성을 확인할 예정이다.
 | | (그래픽=이데일리 문승용 기자) |
|
이번 임상은 18세 이상~65세 미만의 여성 104명을 대상으로 하며, 이중눈가림, 무작위배정 등의 방식으로 14일 간 약물을 질내 직접 투약한 뒤 6개월의 모니터링 기간을 거쳐 종료된다.
건강보험심사평가원(HIRA) 빅데이터 개방 포털에 따르면 2022년 기준 국내 질염 환자 수는 170만명에 달한다. 이중 세균성 질염이 차지하는 비중이 40~50%로 가장 크다.
에이투젠은 질염은 여성의 약 75%가 평생 한 번 이상 걸릴 정도로 흔한 질병이라는 점과, 향후 LABTHERA-001의 적응증 확장 가능성 등을 토대로 시장성을 높게 보고 있다. 특히 세균성 질염은 재발이 잦아 현재 치료제로 쓰이는 항생제를 쓰면 내성균주 발생 위험이 높아져 나중에는 치료제가 잘 듣지 않는다는 단점이 있다.
에이투젠 관계자는 “LABTHERA-001은 단순히 치료제라기보다 ‘재발방지제’에 가까워 치료제 자체의 시장규모와는 차이가 있을 수 있다”면서도 “지금은 세균성 질염을 타깃으로 임상 2a상을 진행 중이지만 향후 자궁내막증, 다낭성난소증후군 등으로의 확장 가능성이 있다”고 말했다.
앞서 페링 파마슈티컬스의 ‘리바이오타’와 세레스 테라퓨틱스의 ‘보우스트’가 1·2호 마이크로바이옴 신약으로서 재발성 클로스트리디움 디피실 감염증(CDI) 치료제로 미국 식품의약품(FDA)의 허가를 받아 시장에 나왔다. 하지만 마이크로바이옴 신약에 대한 시장의 높은 기대감에 비해 매출 성장세가 더딘 상테다.
세레스는 올해 1분기 보우스트의 순매출이 1010만 달러(약 144억2000만원)라고 밝혔는데 매분기 지속적으로 환자와 처방건수가 늘고 있다는 점은 특기할만한 부분이지만 재발 예방 등 적응증이 한정적인 까닭에 완만한 성장곡선을 그리고 있다. 다만 업계에서는 세레스가 지난 9월 네슬레 헬스사이언스에 보우스트를 매각하는 절차를 종료함에 따라 내년부터는 성장세에 힘이 실릴 것으로 기대하고 있다.
에이투젠은 앞서 FDA의 허가를 받은 마이크로바이옴 치료제에 비해 LABTHERA-001가 강점을 갖고 있다고 보고 있다. 리바이오타의 경우 건강한 사람의 대변을 제조해 그 미생물총을 내시경으로 환자의 장내에 뿌리는 방식의 CDI 재발방지제다. 접근성이 높지 않을뿐더러 부작용에 대한 우려도 있었다. 보우스트는 최초의 경구용 마이크로바이옴 신약으로 편의성이 높았지만 소화과정에서 담즙이나 위산 등에 의해 유산균이 소실될 수 있다.
반면 LABTHERA-001은 많이 사용되는 기존 질염치료제처럼 직접 질내 투약하는 방식을 택했다. 에이투젠 관계자는 “경구약은 소화기관 등을 지나서 타깃에 작용해야 하지만 LABTHERA-001은 환부에 약물을 직접 넣기 때문에 손실 없이 약물이 타깃부위까지 도달하게 된다”고 설명했다. 호주에서 진행된 임상 1상에서도 참가자들의 수용도가 높았던 것으로 나타났다.
글로벌 시장조사기업 맥시마이즈 마켓리서치는 2023년 기준 31억 3605만 달러(약 4조5000억원)였던 세균성 질염 치료제 시장이 2030년 59억 6502만 달러(약 8조5000억원)로 성장할 것으로 예상하고 있다.
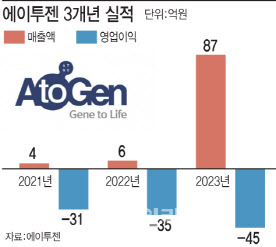
에이투젠은 유한양행이 지분 62.6%를 보유하고 있는 마이크로바이옴 치료제 개발사다. 현재 회사의 주요 매출은 유한양행과 함께 판매하고 있는 혈당과 당화혈색소 수치를 낮추는 효과의 기능성 유산균 ‘혈당엔 유산균 HAC01’이다. 지난해 에이투젠의 매출액은 87억원을 기록했다.










![인도, 글로벌 저가 제네릭에서 바이오 허브로 탈바꿈[제약·바이오 해외토픽]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/02/PS26020700379b.jpg)