팜이데일리 프리미엄 기사를 무단 전재·유포하는 행위는 불법이며 형사 처벌 대상입니다.
이에 대해 팜이데일리는 무관용 원칙을 적용해 강력히 대응합니다.
[이데일리 송영두 기자] 삼천당제약의 성장 모멘텀으로 아일리아 바이오시밀러와 함께 핵심 기술로 강조돼 왔던 경구용 플랫폼 ‘S-PASS’ 원천 기술이 특허성을 인정받지 못한 것으로 드러났다. 그동안 회사 측이 해당 기술로 경구용 비만·당뇨치료제 사업을 추진하면서 투자자들의 기대를 한 몸에 받았던 만큼 불확실성에 따른 논란과 후폭풍이 예상된다.
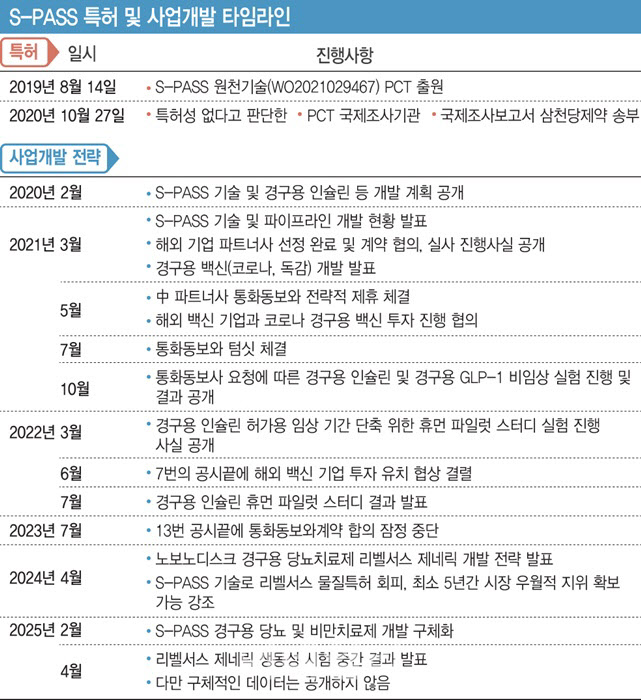
12일 이데일리 취재 결과 삼천당제약(000250)의 S-PASS 플랫폼 원천 기술 특허가 이미 5년전인 2020년 국제조사기구로부터 진보성이 없어 특허 기술 조건을 갖추지 못했다는 판단을 받은 것으로 확인됐다. 삼천당제약 주가는 S-PASS 플랫폼 기술이전과 제품 상용화에 따른 실적 상승 기대감에 10만원 초반대던 주가가 20만원 이상까지 치솟은바 있다.
S-PASS 원천 기술은 ‘경구 투여용 고형 제형 및 그 제조 방법’(Oral Solid Dosage Form and Method for Preparing the Same)이다. 해당 기술은 인슐린과 같은 고분자 의약품의 경구 투여가 가능하도록 하는 고체 제형 및 제조 방법에 관한 것으로, 자가 나노 유화 약물 전달 시스템(The Self-Nano Emulsified Drug Delivery System)을 통해 소장에서 약물 흡수를 촉진하고, 위장에서의 분해를 방지하는 것이 핵심이다.
 | | 삼천당제약이 PCT(특허협력조약) 특허 출원한 S-PASS 플랫폼 원천 기술 ‘Oral Solid Dosage Form and Method for Preparing the Same’에 대한 국제조사보고서.(자료=WIPO) |
|
삼천당제약은 해당 기술을 2019년 8월 14일 PCT 출원했다. PCT(특허협력조약)는 해외 특허를 취득하기 위한 절차 간소화 방식이다. 특허청에 따르면 PCT는 한번의 국제 출원으로 여러 국가에 특허를 신청할 수 있는 제도다.
PCT 출원은 먼저 조약 및 조약규칙에서 정하는 방식 및 언어로 기재된 출원서 등을 수리관청이나 국제사무국에 제출한 후 국제조사기관의 국제조사(ISA)를 통해 선행기술조사 및 특허성 유무를 판단하는 순서를 거친다. 이후 국제조사보고서(ISR) 및 견해서(WOSA)를 포함한 국제출원 서류 일체를 공개하게 되고, 국제예비심사를 통해 특허성 유무에 관한 예비적 판단을 받는다. 국제조사는 PCT 동맹총회에서 국제조사기관으로 지정된 특허청이 수행한다. PCT 국제조사기관은 한국 특허청을 비롯해 미국, 유럽, 중국, 일본 등이다.
일반적으로 한국에서 특허를 등록하면 12개월 이내 개별 국가에 출원해야 우선권을 주장할 수 있지만, PCT 제도를 활용하면 국가별 최대 30~31개월까지 시간을 확보할 수 있다. PCT 과정의 핵심은 국제조사다. 여기서 기술 특허성 여부에 대한 판단이 이뤄지기 때문이다. 하지만 삼천당제약은 국제조사에서 S-PASS 기술에 대한 특허성을 인정받지 못했다.
 | | 삼천당제약 S-PASS 원천 기술에 대해 국제조사보고서가 진보성이 없다고 지적한 부분.(자료=WIPO) |
|
청구항 대부분 진보성 결여, “특허 기술 가치 없다” 해당 기술의 청구항은 크게 11개로 나뉜다. △청구항 1. 인슐린 포함 고형 경구제(알약) 구성 성분과 비율 △청구항 2. 1번 항목의 구체적인 조건 명시 △청구항 3. 환자에 대한 치료 방법 △청구항 4. 경구 제형의 제조 공정 △청구항 5~11. 4번 항목에 대한 혼합 시간, 과립 방식, 타정 압력, 제형 크기 등 세부적 제조 조건 등이다.
국제조사기관은 PCT 출원된 해당 기술에 대해 청구항의 대부분에서 진보성이 없다는 판단을 내렸다. 신규성 측면에서 청구항 1, 2, 4, 11에 대해 긍정적으로 평가했지만, 진보성에 있어서는 기존에 공개된 다른 연구에서의 조합을 통해 전문가들이 쉽게 도출할 수 있다며 부정적인 의견을 제시했다.
특히 제형 핵심 구성요소인 라브라솔을 비롯한 미세결정셀룰로오스, 스테아르산, 마그네슘 알루미노메타실리케이트 등은 기존 공개된 연구에 기재돼 있어 전문가라면 누구나 쉽게 만들 수 있는 수준이라고 평했다. 함량 부분도 전문가가 일상적 실험을 통해 최적화할 수 있는 수준으로 창의적인 발명이 아니라고 판단했다.
경구 제형 제조 방법도 차별성이 없다고 지적했다. 일반적인 제형 공정과 다를게 없다는 판단이다. 타정 압력, 과립 크기, 혼합 시간 등도 특별한 기술적 가치가 없다고 봤다. 결과적으로 해당 기술은 이미 공개된 기존 기술을 넘어서는 창의성이 없다고 판단, 특허성이 부족하다고 결론 내렸다.
국제조사보고서가 언급한 S-PASS 기술과 유사하다고 판단한 기존 연구는 아일랜드 제약사 메리언 리서치(Merrion Research III Limited)사가 출원한 ‘흡수 촉진제를 포함하는 고형 경구제형’(Solid oral dosage form containing an enhancer)과 미국 프린시피아 바이오파마(Principia Biopharma Inc)가 출원한 ‘펩타이드 치료제를 위한 경구용 제형’(Oral dosage forms for peptide therapeutics) 기술이다. 해당 기술은 각각 2012년 12월 4일, 2016년 2월 18일 특허 등록됐다.
S-PASS PCT 출원 자료를 살펴본 특허법인 제약바이오 전문 변리사는 “국제조사기관은 결국 특허 기술이 될 수 없다고 판단한 것”이라며 “회사 측이 권리화하고자 하는 청구항에 비해 데이터가 별로 없다”고 전했다.
 | | (자료=한국거래소, 삼천당제약 IR 자료. 이데일리 재구성. 그래픽=김일환 기자) |
|
삼천당제약, 사실 인지하고도 S-PASS 띄우기 지속 삼천당제약은 국제조사기관의 해당 결과를 2020년 10월 중 알았을 가능성이 높다. PCT 특허출원 후 국제조사보고서는 16개월 이내 작성해 출원인에게 송부하게 되는데, S-PASS 기술 국제조사보고서는 2020년 10월 27일 발송됐기 때문에 삼천당제약 측도 이날 특허성을 인정받지 못했다는 사실을 인지했을 것으로 추정된다. ‘PCT 국제조사 및 국제예비심사 가이드라인’에 따르면 국제조사보고서와 견해서가 일단 작성되면 국제조사기관은 같은 날에 국제사무국과 출원인에게 각각 이들 문서의 사본 1부씩을 송부하기 때문이다.
삼천당제약이 시장에 S-PASS 기술과 관련 사업 추진을 최초로 알린 시점은 2020년 2월이다. 2019년 2월 IR에서는 S-PASS 기술이나 경구용 개발에 대한 언급이 없었던 반면, 이후 1년 만인 2020년 2월 개최한 IR에서는 ‘No Needle Platform Biz’ 사업을 통해 차세대 성장 동력이라며 최초로 S-PASS 기술과 경구용 인슐린, 경구용 GLP-1 개발 추진 계획을 공개했다. 특히 2020년 9월 열린 IR에서는 S-PASS 플랫폼 기술과 파이프라인 전략 설명에 모든 시간을 투자할 정도로 홍보에 열을 올렸다. 개발명까지 부여돼 소개된 파이프라인은 경구용 인슐린(SCD0503), 경구용 삭센다(SCD0506, SCD0507), 경구용 엔브렐(SDC0509)이었다.
문제는 S-PASS 기술에 대한 국제조사 특허성 판단을 인지하고 있었을 시점인 2021년 3월 25일에도 삼천당제약은 IR을 개최하고 S-PASS 기술과 파이프라인(SCD0503, SCD0506) 개발 현황에 대해 공개했다. 특히 미국, 일본, 중국 파트너사 선정 완료 및 계약 협의, 실사를 진행 중이라고 분위기를 띄우기까지 했다. S-PASS 기술을 활용한 경구용 백신(코로나, 독감) 개발 추진 소식도 새롭게 전했다.
2021년 5월 4일에는 해외 기업과의 협상 소식이 뒤늦게 공개되기도 했다. 당시 삼천당제약은 공시를 통해 “중국 파트너사와 2020년 11월 오럴 인슐린(SCD0503) 및 오럴 GLP-1(SCD0506)에 대한 전략적 제휴(LOI)를 체결했다”며 “현재는 중국 및 미국 파트너사와 해당 제품에 대한 Technical Due Diligence(실사) 및 비즈니스 관련 사항(파트너사 해당 지역 임상 비용 전액 부담 조건을 포함한 마일스톤과 로열티 지급 조건 등)을 협의하고 있다”고 발표했다. 이후 중국 파트너사가 통화동보사인 것과 텀싯 체결까지 공개했지만 2023년 7월 28일까지 13번 공시 끝에 계약 협의가 잠정 중단됐다고 선언했다.
비슷한 시기(2021년 5월 7일) 공시를 통해 발표한 해외 백신 전문회사와 코로나 경구용 백신에 대한 투자 진행 협의 건도 2022년 6월 3일까지 7번의 공시 끝에 협상 결렬로 마무리됐다. 해외 기업과의 대규모 계약을 기대했던 투자자들의 투심은 공시 발표때마다 요동쳤다.
이후 2024년 4월 IR을 통해 노보노디스크가 개발한 경구용 당뇨치료제 리벨서스 제네릭(Oral Semaglutide) 개발 추진 소식을 새롭개 공개하며, 기존 파이프라인의 개발 타임라인까지 발표했다. 특히 리벨서스 제네릭 개발에 대해 “S-PASS 기반 독자적인 위장 점막 투과제 확보로 물질특허가 종료되는 2026년~2031년 사이 판매가 가능하다. 최소 5년간 시장의 우월적 지위 확보가 가능하다”고 설명했다. 노보노디스크 리벨서스 제형 특허를 회피해 시장 조기 진입이 가능하다고 주장한 것이다.
올해 들어서는 더욱 구체화한 S-PASS 경구용 당뇨 및 비만 치료제 개발 전략을 소개했고, 리벨서스 제네릭의 2026년 조기 상업화와 글로벌 첫번째 경구용 GLP-1 개량신약을 개발해 게임체인저가 될 것이라고 강조하고 있다.
삼천당제약은 2019년 8월 16일 보도자료를 통해 S-PASS 플랫폼 기술의 PCT 특허 출원 사실을 밝힌 바 있고, 2020년 2월 및 2020년 9월 IR에서도 반복적으로 PCT 출원 소식을 강조했다. 하지만 PCT 특허 출원 관련 국제조사 결과에 대해서는 지금까지도 밝히지 않고 있다.
이데일리는 사실 확인과 반론권 차원에서 삼천당제약 측에 2019년 PCT 출원한 특허(WO2021029467) 관련 내용과 국제조사 결과에 대한 사실 여부를 물었지만, 회사 측은 답변을 회피했다.











