팜이데일리 프리미엄 기사를 무단 전재·유포하는 행위는 불법이며 형사 처벌 대상입니다.
이에 대해 팜이데일리는 무관용 원칙을 적용해 강력히 대응합니다.
[이데일리 김지완 기자] 젬백스앤카엘의 알츠하이머병 치료제 ‘GV1001’이 글로벌 임상 2상에서 통계적 유의성을 확보하지 못했다는 발표 이후 논란이 확산하고 있다.
시장에선 “1차 평가지표 실패”라며 부정적 평가가 쏟아지는 반면, 회사 측은 “위약군의 비정상적 수치가 결과를 왜곡했다”며 반박에 나섰다.
 | | 김상재 젬백스 고문(창업자)이 이데일리와 경기도 성남시 본사에서 인터뷰 중이다. (사진=김지완 기자) |
|
이데일리는 11일 김상재 젬백스 고문(창업주)을 단독 인터뷰해 ‘임상실패냐, 아니냐’는 논란에 대해 문의했다.
“글로벌 평균 절반 수준…GV1001 위약군 수치 이례적” 첫 번째 논란은 위약군이다. GV1001 0.56㎎, 1.12㎎ 투약군에서 각각 4.14점, 4.31점을 기록했다. 이는 위약군 4.30점 대비 통계적으로 유의한 차이가 나타나지 않았다.
김 고문은 “GV1001 위약군의 수치가 비정상적으로 나온 것이 통계적 유의성을 확보하지 못한 원인”이라며 “위약군이 1년 간 4.3점 나빠졌는데, 세계 평균 알츠하이머병 진행속도는 -7.91점”이라고 말했다.
김 고문이 말한 글로벌 평균 -7.91점은 임상신경학 분야 최고 권위 학술지 ‘JAMA Neurology’를 근거로 한 것이다. 즉, 외부 대조군과 비교했을 때 GV1001 위약군의 악화폭은 현저히 더뎠던 것은 사실이다.
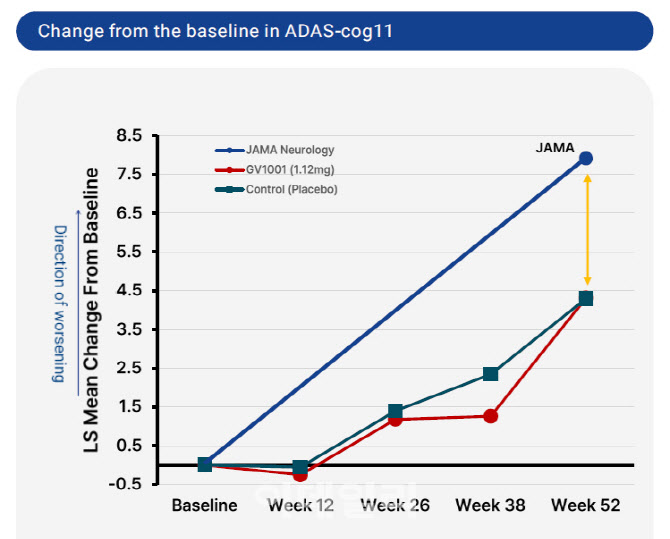 | | 알츠하이머병의 1년 간(52주) 세계 평균 인지저하는 -7.91점이다. GV1001의 위약군 4.30점은 세계 평균과 큰 차이가 난다. (제공=JAMA Neurology, 젬백스) |
|
더욱이 레켐비(Leqembi, 성분명 레카네맙·lecanemab)가 초기 알츠하이머병 환자를 대상으로 치료했지만 인지기능 저하 속도가 GV1001 보다 빠르게 나타났다는 점에서 의문을 표시했다. 레켐비는 일본 에자이(Eisai)와 미국 바이오젠(Biogen)이 공동 개발한 알츠하이머병 치료제로, 2023년 7월 미국 식품의약국(FDA) 정식 승인을 받았다.
김 고문은 “레켐비 임상을 자세히 들여다보면 ‘경도 인지장애’가 544명(61.5%), 경증 331명(37.5%)으로 위약군이 총 875명이었다”며 “경도 인지장애 환자가 경증 환자 대비 1.64배 많았다”고 강조했다. 이어 “레켐비 임상에 극초기 환자가 다수를 차지했음에도, 위약군 인지기능 저하 폭이 GV1001 경증 환자보다 1.88배 높았단 점은, 단순한 환자 구성 차이로 설명하기 어렵다”고 지적했다.
레켐비는 경도 인지 장애 및 경증 환자를 대상으로 임상 3상을 했고, GV1001은 한 단계 높은 경증 및 중등증을 대상으로 글로벌 임상 2상을 수행했다. 젬백스는 레켐비의 ‘경도 인지장에+경증’ 환자들이 GV1001 ‘경증’ 환자보다 인지기능 속도가 더 빠르다는 것을 납득할 수 없다는 입장이다.
경도 인지 장애는 치매로 진행되기 전 경미한 인지기능 저하 상태를 의미한다. 정상인보다 기억력, 주의력, 언어능력 등 인지기능이 떨어져 있지만 일상생활 수행 능력은 거의 유지되는 상태다. 정상과 치매 중간단계로 볼 수 있다.
알츠하이머병은 ‘경도 인지 장애’(MCI) → 경증(Mild) → 중등증 (Moderate)→ 중증(Severe) 순으로 진행된다. 단계가 올라갈수록 인지기능 저하 절대 폭과 속도가 빨라진다.
국내선 성공, 글로벌선 실패…‘통계 왜곡’ 가능성 제기 두 번째 논란은 국내 임상 2상을 성공했는데, 글로벌 임상 2상은 왜 실패했는가다.
젬백스는 앞서 중등증 및 중증 알츠하이머병 환자를 대상으로 한 국내 2상 임상시험에서 ‘중증장애점수’(SIB)에서 통계적 유의성을 입증했다.
당시 임상시험에서는 SIB 점수가 대조군에서는 7.23점이 감소했지만, GV1001 1.12㎎ 투약군에서 0.12점의 감소에 그쳤다. 단 6개월 임상에서 투약군과 위약군 간 점수 차이가 7.11점에 달했다. 이번 글로벌 임상 2상은 국내 임상 2상과 180도 달라진 결과가 도출된 것이다.
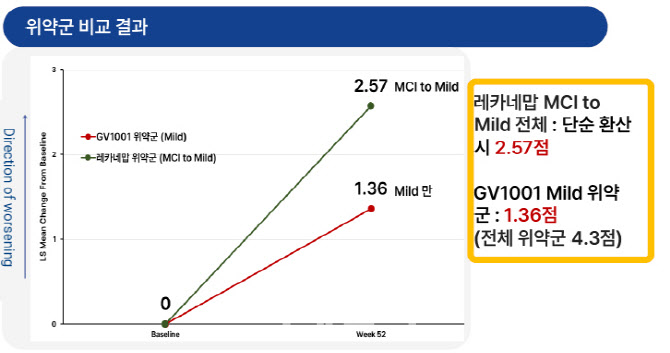 | | 레켐비(레카네맙)은 경도 인지장애(MCI) 포함 초기 환자군이었음에도 인지 저하가 더 빨랐고, GV1001 ‘경증’ 환자들은 상대적으로 느린 저하를 보였다. (제공=젬백스) |
|
젬백스 측은 평가자의 편차·임상기관 간 점수 일관성 결여로 인한 결과 왜곡 가능성을 의심했다.
감 고문은 “좀 더 면밀하게 조사·분석을 해야한다”고 전제하면서도 “통계적 오류 가능성이 높다”고 추정했다.
그는 “일부 평가센터에서 환자 점수를 동일하게 부여하거나, 경미한 변화에 분별력이 떨어졌을 가능성도 있다”며 “현재 기관별 점수 패턴을 전수 검증하고 있으며, 동일 환자를 평가한 의료진 일관성 여부를 조사 중”이라고 밝혔다.
즉, 임상 실패’가 아니라 통계적 오류로 본다는 얘기다.
김 고문은 “임상 운영상 통제 미흡 가능성”을 언급했다. 여기서 말한 통제 미흡 가능성은 위약군 일부에서 도네페질 등 기존 알츠하이머 치료제를 복용했을 가능성도 배제할 수 없다는 뜻이다.
알츠하이머병의 경우 치료 중단 상태를 만들면 윤리적 문제가 제기될 수 있다. 따라서, 위약군에서도 도네페질을 투약하는 경우가 있다. 이 경우 위약군의 인지 저하 속도가 둔화돼 결과가 왜곡됐을 수 있다.
레켐비엔 없던 안전성…‘무(無) 아리아’ 입증” 안전성 측면에서는 오히려 확실한 강점을 입증했다.
김 고문은 “레켐비의 경우 투약 과정에서 뇌부종·뇌출혈 등 아리아(ARIA) 부작용이 보고돼 환자마다 최대 5회의 MRI 촬영이 의무화돼 있지만, GV1001 임상에서는 단 한 건의 ARIA 사례도 발생하지 않았다”고 강조했다. 이어 “이는 고령층, 특히 기저질환을 가진 환자에게 적용 가능한 안전한 치료제라는 점에서 의미가 크다”고 덧붙였다.
아리아는 ‘아밀로이드 관련 영상 이상’(Amyloid-Related Imaging Abnormalities)의 약자로, 뇌 속 아밀로이드 단백질을 제거하는 항체 치료제 투여 시 MRI에서 관찰되는 대표적 부작용이다. 주로 뇌부종(ARIA-E) 또는 뇌출혈(ARIA-H) 형태로 나타나며, 증상으로는 두통·구토·의식 저하 등이 동반될 수 있다.
레켐비(레카네맙)나 아두헬름(아두카누맙) 등 기존 항아밀로이드 계열 약물에서 반복적으로 보고됐으며, 환자 중 최대 40%에서 경·중증 아리아가 발생한 것으로 알려져 있다.
이 때문에 FDA는 해당 약물 투여 시 정기적인 MRI 모니터링을 의무화하고, 약품 포장에 ‘아리아로 인한 심각한 부작용 가능성’을 경고 문구(블랙박스)로 명시하고 있다.
“복수 해외 제약사로부터 기술수출 협상 중” 바이오마커 측면에서도 의미 있는 변화를 확인했다.
김 고문은 “GV1001 투여군에서는 뇌 신경 손상 지표인 NfL(Nerve Filament Light chain) 농도가 감소하고, 염증을 반영하는 GFAP(Glial Fibrillary Acidic Protein) 수치가 유의미하게 낮아졌다”고 설명했다. 또한 “성상교세포(astrocyte) 활성 억제와 타우 단백질(p-tau181, p-tau217) 변화 양상이 관찰돼, 약물이 실제로 뇌 속 병리 기전에 작용하고 있음을 보여줬다”고 덧붙였다.
이는 단순한 증상 완화를 넘어, 질병 진행 자체를 늦추는 ‘질환 조절제’(disease-modifying) 가능성을 시사한다는 평가다.
김 고문은 “혈액 기반으로도 동일한 경향의 바이오마커 변화를 확인한 만큼, 향후 MRI 없이 혈액검사만으로 치료 효과를 모니터링할 수 있을 것”이라고 밝혔다.
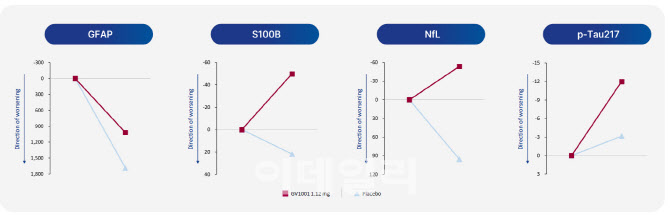 | | GV1001 알츠하이머병 글로벌 임상 2상에서의 바이오마커. (제공=젬백스) |
|
GV1001이 알츠하이머병 임상 3상 단계로 진입할 과학적 근거를 확보했다 하더라도, 막대한 임상비용을 어떻게 조달할 것인가가 최대 과제다.
하지만 젬백스는 이미 그 우려를 기술수출 협상 진행상황을 공개하며 불식시켰다.
김 고문은 “임상 3상에만 약 5000억원이 소요되는 만큼, 글로벌 빅파마와 공동개발 또는 기술이전 필수”라며 “복수의 해외 제약사와 협의를 진행 중이다”고 밝혔다.
그는 “GV1001은 안전성에 더해 중증에서 인지기능 개선, 뇌 신경 염증 완화, 삶의 질(QoL) 향상까지 확인됐다”며 “세계적으로 이 같은 효능 데이터를 내놓은 알츠하이머병 치료제가 드물다”고 말했다.
2차 지표인 삶의 질은 일상생활 수행 능력, 수면의 질, 정서적 안정 등을 보는 항목이다. 레켐비는 임상에서 삶의 질 항목이 악화됐다.
한편, 레켐비 역시 임상 2상에서 1차 평가변수를 충족하지 못했다. 아리바이오의 AR1001 역시 알츠하이머 치매 임상 2상에서 1차 유효성 평가변수를 충족하지 못했지만, 사후분석으로 글로벌 임상 3상을 진행 중이다. 임상적 경향, 바이오마커, 기전적 타당성이 확인되면 임상 3상으로 가는 것이 현 추세다.






![LG화학도 탐냈던 AI신약개발사 히츠…"젊은 천재와 노련한 선장"[사제 공동창업]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/02/PS26020700165b.jpg)


![문여정 IMM인베스트먼트 전무 "ADC·DDS·CNS 주목"[바이오 VC 집중조명⑩]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/02/PS26020600489b.jpg)
![인도, 글로벌 저가 제네릭에서 바이오 허브로 탈바꿈[제약·바이오 해외토픽]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/02/PS26020700379b.jpg)

