팜이데일리 프리미엄 기사를 무단 전재·유포하는 행위는 불법이며 형사 처벌 대상입니다.
이에 대해 팜이데일리는 무관용 원칙을 적용해 강력히 대응합니다.
[이데일리 김승권 기자] 딥카스로 지난해 200억원을 벌어들인 뷰노(338220)가 유럽연합(EU) 27개국으로 판매처를 확장할 수 있게 됐다. 최근 EU에서 새롭게 개정된 CE 인공지능(AI) 의료기기 허가를 획득하면서다.
뷰노는 국내 기업 최초로 생체신호를 통한 심정지 예측 의료기기 판매 허가를 받았다. 뷰노는 이와 함께 유럽서 다수의 미국 식품의약국(FDA) 허가를 받은 의료기기 기업과 판매 대리 계약도 체결했다. 유럽은 세계 AI의료기기 시장의 약 30%를 점유하며 미국에 이어 두번째 높은 시장 규모여서 매출 상승 기대 효과가 큰 상황이다. 유럽의 2023년 AI의료기기 시장 규모는 약 1조 6000억원이고 2030년에는 7조원 규모로 성장할 예정이다.
이예하 뷰노 대표는 “유럽 시장 진출 시도는 몇년 전부터 해 왔다”며 “다만 최근 유럽에서 의료기기 관련 정책이 변화되어 내년에 허가가 가능할 것으로 예상했는데 빠르게 승인이 나와서 매출 상승 기대감이 높은 상황”이라고 설명했다.
생체신호 심질환 예측으로 EU 최초 허가...법인 설립 계획은 11일 AI의료업계에 따르면 뷰노의 심정지예측 AI의료기기 ‘딥카스’가 유럽의약품청(EMA)으로부터 MDR CE 인증을 획득했다. 생체신호를 통한 심질환 예측 의료기기 분야에선 최초의 허가다.
유럽 인공지능법이 세계 최초로 제정된 후 5월부터 MDR(Medical Device Regulation) CE 인증 없는 제품의 판매가 금지됐다. 기존 MDD(Medical Device Directive) CE 대비 유럽 자체 임상 등 품질심사 기준이 강화되면서다. 이에 뷰노는 발빠르게 선제적 조치에 나섰고 빠른 허가에 성공했다.
딥카스는 지난해 매출 200억원을 올리며 단일 제품으로 국내 최대 매출을 기록한 AI의료기기다. 딥카스는 일반 병동의 전 연령 입원 환자를 대상으로 전자의무기록(EMR)에 입력된 5가지 활력 징후(수축·이완 혈압, 맥박수, 호흡수, 체온)와 나이, 측정시간을 실시간으로 분석해 24시간 이내 심정지 발생 위험도를 0~100점 사이의 점수로 표시한다. 일반 병동에서도 주로 활용하는 필수적인 5개 활력 징후만 사용하기에 EMR 시스템과 연동하기만 하면 추가적인 업무 없이 효율적으로 중증 악화 발생 위험을 감지할 수 있는 것이 특징이다.
 | | 딥카스 관련 설명 (사진=뷰노) |
|
이 때문에 유럽에서 생체신호 분석 기기 중 AI 축척 데이터 등 분야에서 강점이 확실하다는 것이 이예하 대표의 설명이다. 이 대표는 “유럽 내 경쟁자들과 비교할 때 강점이 분명하기 때문에 현지 기업과 이미 파트너십을 체결했고 판매가 빠르게 진행될 예정”이라며 “일단 파트너를 통해 대리 판매하고 직접 영국, 독일 쪽 법인 설립도 검토하고 있다”고 말했다.
인공지능 기반 심전도 측정 의료기기 ‘하티브 P30’도 CE MDR 인증과 영국의 인증제도인 UKCA를 획득하며 투트랙 전략으로 영업이 전개될 예정이다.
연내 흑자전환이 가능할 것으로 회사 측은 보고 있다. 이 대표는 “매출은 꾸준히 잘 증가되고 있는 상태라서 올해 하반기 정도에 손익분기점(BP)를 맞추는 것을 목표로 하고 있다”고 예상했다. 허성규 신한투자증권 연구원도 “올해 뷰노의 매출액은 전년 대비 57.8% 증가한 408억원을, 같은 기간 영업이익은 3억원을 기록해 흑자 전환할 것으로 보인다”며 “이 중 대부분의 수익은 딥카스(343억원)에서 나올 것”이라고 내다봤다.
미국·유럽 동시 공략...현재 상황은 뷰노는 미국과 유럽 시장 동시 공략을 노리고 있다. 유럽에 이어 미국 시장에 성공적으로 진입하면 큰 성장을 이룰 수 있는 상황이다. 통상 미국 시장을 한국(약 3000억원)의 10배 이상으로 보는데 미국 생체신호 기반 중증 악화 예측 기기 시장은 최소 3조원 이상으로 추정된다. 여기에 10%만 달성해도 3000억원의 매출이 가능하다.
뷰노는 올해에는 딥카스의 미국 FDA 승인이 가능할 것으로 보고 있다. 기존 미국의 FDA 정책 변화로 미국 임상을 실시해야해서 승인이 다소 지연됐다는 설명이다.
이 대표는 “기본적으로 보든 이게 의료 시장 자체가 미국이 우리나라보다 10배 이상 크다는 것은 일반적으로 알려진 얘기”라며 “딥카스는 미국 FDA로부터 ‘브레이크스루 디바이스(혁신의료기기)’ 지정을 받았기 때문에 이미 혁신성과 임상 유효성이 일정 부분 인정됐다. 하지만 미국 자체 임상 문제로 지연됐지만 올해는 가능할 것으로 본다”고 예상했다.
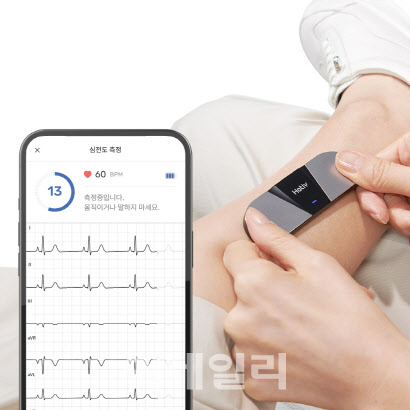 | | 하티즈 제품 작동 모습 (사진=뷰노) |
|
허가 이후 미국 수가 제도 진입도 가능할 것으로 내다봤다. 미국 보험청(CMS)은 신기술 추가 보상(NTAP, 엔텝)과 혁신급여 메디케어 지불 보상(MCIT)을 통해 혁신 기술 및 의료기기를 대상으로 건강보험 수가를 적용한다. NTAP 적용 요건은 신규 의료 기술·서비스여야 하고, 긴급의료 대상일수록 가능성이 높다. 딥카스가 중증환자를 대상으로 한 의료기기여서 승인 가능성은 충분하다는 게 이 대표의 설명이다. 엔텝에 적용되면 3년간 포괄수가제(어떤 질병이냐에 따라 책정된 일정액의 진료비를 부담하는 제도) 지불액 초과 비용의 65% 또는 신기술 비용의 65% 가운데 작은 금액이 적용된다. 미국에선 이미 비즈AI 등과 같은 기업이 NTAP에 승인돼 1000억원 가량의 매출을 올린 바 있다.
뷰노는 특허 확보에도 주력하고 있다. 최근 의료영상 분석을 위한 핵심 기술에 대한 특허와 생체신호 분석을 위한 핵심 기술에 대한 특허가 미국에서 등록됐다.
그는 “FDA로부터 혁신의료기기로 지정된 것으로 볼 때 미국 수가 획득 가능성은 충분하다고 본다”며 “NTAP 선정 요건 중 혁신성과 잠재적 임상 유효성을 인정받은 것인데 이렇게 되면 FDA 승인 이후 수가화 가능성이 높아진다”고 강조했다.









![트럼프Rx 태풍속…'주력약 퇴출' 삼일↓·'M&A 기대' 오스코텍↑[바이오맥짚기]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/02/PS26020900106b.jpg)

