[이데일리 이광수 기자]
에이비엘바이오(298380)와
한독(002390)이 내달 담도암 치료제로 개발하고 있는 파이프라인 ‘ABL001’의 임상2상 결과를 발표한다. 지난 5월에 발표된 중간 데이터가 긍정적이어서 시장 기대감이 높다. 에이비엘바이오는 우수한 2상 결과를 바탕으로 미국 식품의약국(FDA)으로부터 희귀의약품 지정(ODD)과 조건부허가 등을 계획하고 있다.
FDA는 미충족 의료 수요가 큰 희귀 질환의 신약개발을 지원하기 위해 희귀의약품 지정 제도를 운영중이다. 희귀의약품으로 지정되면 △임상 비용의 50%에 대한 세액공제 △신약허가 신청 비용 면제 △동일 계열 제품 중 첫 시판 허가 시 7년간 시장 독점 등을 제공한다.
ABL001의 국내 판권은 한독이 갖고 있다. 중국 판권은 엘피 사이언스, 이를 제외한 글로벌 판권은 컴패스 테라퓨틱스가 각각 보유하고 있다. ABL001의 성공에 따라서 이들 기업의 가치도 함께 커지는 것이어서 국내외 투자자들의 관심이 쏠리고 있다.
23일 제약·바이오 업계에 따르면 내달 19일부터 21일까지 열리는 미국 임상종양학회 소화기암 심포지엄(ASCO GI)에서 에이비엘바이오의 담도암 치료제 후보물질 ABL001(HD-B001A, CTX-009)의 임상 2상 결과가 발표된다. 글로벌 개발 파트너인 컴패스 테라퓨틱스(CMPX)가 소개한다.
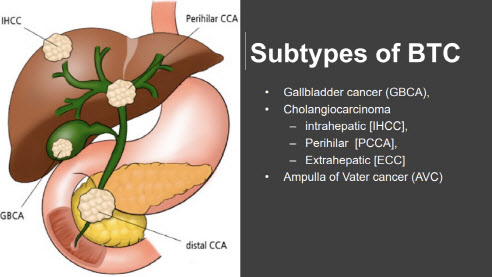 | | ABL001 기전 (자료=컴패스 테라퓨틱스) |
|
ABL001은 ‘VEGF’와 ‘DLL4’를 동시에 표적해 암 조직 내 신생혈관 생성을 억제해 암을 사멸 시키는 기전의 이중항체 치료제다. 임상2상은 두 종류로 진행되고 있다. 파클리탁셀(Paclitaxel)과의 병용 임상과 별도로 진행되는 비교임상이 있다.
지금 시점에서 투자자들이 주목해야 할 것은 앞선 임상 결과다. 글로벌 파트너사인 컴패스 테라퓨틱스가 지난 5월에 발표한 파클리탁셀과 병용하는 임상2상 중간결과를 보면 객관적 반응률(ORR)이 42%에 이른다. 임상이득률(CBR)의 경우 92%에 달했다. ORR은 사전에 정한 기간 동안 정의된 양 이상 종양이 감소한 환자 비율을 말한다. CBR은 ORR과 무진행생존율을 함께 고려한 수치다.
현재 의료현장에서는 담도암의 경우 화학항암제 병용 요법을 1차적으로 고려한다. 약 10년 넘게 사용되면서 표준치료법으로 자리잡았다. 이 표준요법의 ORR은 18.7%다. 아직 표준화된 2차 치료제는 없다. 2차 치료제로는 폴폭스를 대개 처방받게 된다. 업계 관계자는 “폴폭스의 경우 ORR이 5%에 그친다”고 말했다. 1차 치료제(first line chemotherapy)는 암을 진단 받고 처음으로 사용되는 치료방법을 뜻한다. 여기서 치료 효과가 확인되지 않으면 두번째로 사용되는 치료요법이 2차 치료제다.
지난 9월에는 새로운 치료법이 미국 식품의약국(FDA)의 승인을 받았다. FDA는 아스트라제네카의 임핀지와 젬시타빈, 시슬리플라틴 병용요법을 승인했다. 이 경우는 ORR이 26.7%로 표준치료법을 앞서면서 새로운 패러다임을 제시한 바 있다. 기존 표준치료제보다 높은 치료효과로 1차 치료제로 거론되고 있다.
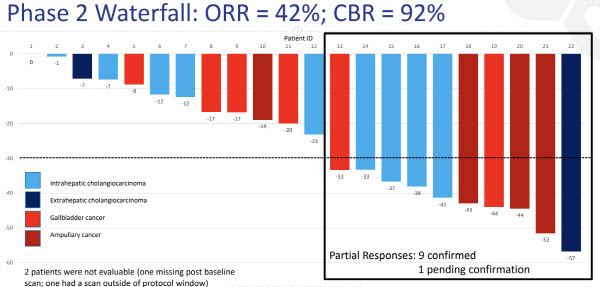 | | ABL001 임상2상 중간 데이터 (자료=컴패스 테라퓨틱스) |
|
다만 에이비엘바이오의 ABL001과 파클리탁셀의 병용요법은 ORR 41.6%로 효과성은 가장 높게 분석돼며 아스트라제네카의 병용투여를 앞섰다. 에이비엘바이오 관계자는 “담도암에 대한 마땅한 치료제가 없는 상황이다. ABL001이 상용화 된다고 할 경우 기존 치료법 대비 경쟁력이 있을 것”이라고 예상했다.
지난 5월 발표된 중간 데이터에서 좋은 성과를 받은 만큼 투자자들의 관심은 임상 2상 이후 전략에도 관심이 쏠린다. 에이비엘바이오 관계자는 “우수한 결과가 나오게 되면 희귀의약품지정과 조건부허가까지 진행하는 것을 검토하고 있다”고 말했다. 회사측에서 자료를 FDA에 신청서를 제출하면 희귀의약품 승인 절차가 시작된다. 내달 긍정적인 데이터를 받아들고 곧바로 절차를 밟기 시작한다면, 내년 안에는 결과를 받을 수 있을 것으로 전망된다.
시장은 기대감을 반영하고 있다. 나스닥에 상장된 컴패스의 경우 20일(현지시간)기준 올해 들어서만 주가가 36.86% 상승했다.
진행성 담도암은 미국에서만 매년 5만명, 유럽과 일본에서 21만명의 환자가 발병한 질환이다. 국내에서는 2019년 기준 7300명의 환자가 발생했다. 중국에서도 10만명당 7~8명꼴의 발병률을 보이는데, 14억 중국 인구를 고려하면 9만8000여명의 담도암 환자가 발생한 것으로 예상 할 수 있다. 담도암 세계 치료제 시장 규모는 11억6000만달러(약 1조5000억원)로 추산된다. 5년 생존율이 5~15% 수준으로 미충족 의료 수요가 높은 상황이다.







![美훈풍에 노을·넥스트바이오 주가 껑충…젬백스도 상승세[바이오맥짚기]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24112900112b.jpg)
![복용법 까다로운 먹는 골다공증약, 6개월 주기 주사제로 대체 가능[약통팔달]](https://image.edaily.co.kr/images/vision/files/NP/S/2024/11/PS24113000097b.jpg)

