팜이데일리 프리미엄 기사를 무단 전재·유포하는 행위는 불법이며 형사 처벌 대상입니다.
이에 대해 팜이데일리는 무관용 원칙을 적용해 강력히 대응합니다.
[이데일리 김새미 기자] 디앤디파마텍(347850)은 대사관련 지방간염(MASH) 치료제 ‘DD01’을 연내 대규모 기술이전을 하고자 사업개발(BD)에 박차를 가하고 있다.
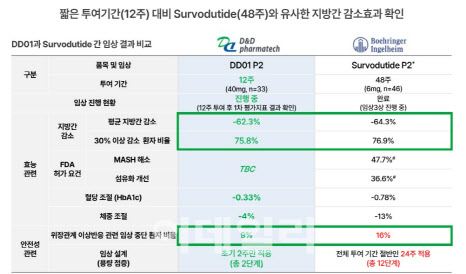
12주 만에 글로벌 경쟁약 못지않은 유효성 입증앞서 디앤디파마텍은 DD01의 미국 임상 2상에서 유효성을 확인했다고 밝혔다. 해당 임상의 1차 지표는 MRI-PDFF 영상 촬영방식을 활용한 위약군 대비 12주차 DD01 투약군의 지방간이 30% 이상 감소한 환자 비율 차이였다. 그 결과 시험약 투여 전(Baseline) 대비 간 지방이 30% 이상 감소한 피험자의 비율은 DD01 투여군에서 75.8%, 위약 투여군에서 11.8%로 그 차이는 통계적으로 유의했다.(p<0.0001)
해당 임상의 2차평가지표는 조직 생검을 통한 48주차 DD01 치료 효과로, 내년 상반기에 결과를 확인할 수 있을 것으로 전망된다. 미국 식품의약국(FDA) 허가 요건을 충족시키기 위해선 24주 또는 48주차 섬유화 악화없는 MASH 해소나 MASH 악화없는 섬유화 개선을 입증해야 하기 때문에 해당 지표는 의미가 크다. 디앤디파마텍은 올해 말 48주 투여가 완료될 것으로 예상하고 있다. 회사 측은 “이번 12주차의 높은 지방간 감소율로 인해 2026년 상반기 조직생검 결과에 대한 기대감이 증가했다”고 설명했다.
 | | DD01과 베링거인겔하임의 ‘서보듀타이드’(survodutide)와 비교 (자료=디앤디파마텍) |
|
특히 고무적인 점은 12주라는 짧은 투여 기간임에도 경쟁 제품인 베링거인겔하임의 ‘서보듀타이드’(survodutide)가 48주간 투여한 임상 2상 결과와 유사한 수준의 지방간 감소 효과를 보였다는 점이다. 서보듀타이드는 48주 만에 평균 64.3%의 지방간 감소를 확인했고, 30% 이상 감소 환자 비율은 76.9%였다. DD01은 12주 만에 평균 지방간 감소 62.3%, 30% 이상 감소 환자 비율 75.8%를 기록했다.
유사한 약효를 내면서도 DD01의 안전성이 더 뛰어난 것으로 나타났다. 서보듀타이드의 위장관계 이상반응 관련 임상 중단 환자 비율은 16%였지만 DD01은 9%(3명)에 불과했다. 디앤디파마텍 관계자는 “대부분의 이상반응은 일시적이었으며 관리 가능한 수준”이라며 “우월한 안전성 프로파일을 확보했다”고 강조했다.
우수한 임상 결과에 초대형 기술이전 기대감 ↑디앤디파마텍은 이번 임상 결과를 토대로 글로벌 제약·바이오기업과 파트너링 논의에 본격 나선다는 계획이다. 디앤디파마텍은 DD01의 기술이전과 글로벌 파트너링을 위해 최근 미국 유수의 투자은행(IB)과 컨설팅 계약도 체결했다. 연내 DD01로 대규모 기술이전 계약을 체결하겠다는 게 회사의 목표이다.
일각에서는 디앤디파마텍이 국내 제약·바이오업계에서 역대 최대 규모의 기술수출 계약을 체결할 수 있다는 관측이 제기됐다. 글로벌 제약사 글락소스미스클라인(GSK)이 지난 5월 20억달러(약 3조7000억원)에 기술 도입한 보스턴 파마슈티컬스(Boston Pharmaceuticals)의 MASH 치료제 ‘에피모스퍼민’(efimosfermin)보다 DD01의 지방간 감소 효과가 더 뛰어나다는 점을 감안하면 이보다 더 큰 규모의 기술이전이 가능하지 않겠냐는 분석에서다.
기존 국내 최대 규모의 기술이전은 지난 4월 에이비엘바이오가 GSK과 4조1000억원 규모에 체결한 뇌혈관장벽(BBB) 셔틀 플랫폼 ‘그랩바디-B’ 기술이전이다. 디앤디파마텍이 이를 뛰어넘는 규모의 기술이전 계약을 체결할 수 있을지 주목된다.
美 FDA 승인 MASH 신약 대비 DD01의 차별성은?현재 FDA 승인을 받은 MASH 치료제는 마드리갈 파마슈티컬스(Madrigal Pharmaceuticals)의 MASH 치료제 ‘레즈디프라’(Rezdiffra)가 유일하다. 그러나 레즈디프라의 섬유화 악화 없는 MASH 해소나 MASH 악화 없는 섬유화 개선 비율은 약 25% 수준으로 대부분의 환자에게선 뚜렷한 치료 효과가 없다는 지적이 제기되고 있다. 가속승인을 받은 상태이기 때문에 후속 임상에서 임상적 유효성을 입증하지 못하면 승인 취소될 가능성도 배제하긴 어렵다.
글루카곤 유사 펩타이드-1(GLP-1) 계열 비만·당뇨 치료제들과 경쟁 구도로 돌입하고 있다는 점도 레즈디프라의 입지를 좁히는 요인이다. 최근 GLP-1 계열 치료제들은 체중 감량을 통해 지방간이나 섬유화를 개선하면서 주목받고 있다. 실제로 노보 노디스크는 이달 초 비만치료제 ‘위고비’의 MASH 임상 3상 파트 1의 성공적인 결과를 기반으로 FDA에 적응증 확대 신청을 완료, 우선 심사 대상으로 선정된 상태다. 뿐만 아니라 GLP-1 계열 치료제들은 간을 포함한 전신 대사 개선에 효과를 보이고 있지만 레즈디프라는 간 특이적이라는 점에서 경쟁력이 떨어진다는 분석이 나온다.
DD01은 기존 GLP-1 수용체 작용제 또는 GLP-1/위 억제 펩타이드(GIP) 이중작용제와 달리 GLP-1/글루카곤(GCG) 이중작용제라는 점에서 GCG에 의한 빠른 지방간 감소를 기대할 수 있다. 간에는 GLP-1, GIP 수용체가 거의 없지만 GCG는 다량으로 분포하고 있기 때문이다. 이 때문에 DD01이 다른 GLP-1 계열 치료제보다 간에 직접 작용해 지방간을 효과적으로 감소시킬 수 있을 것으로 기대된다.
이와 함께 기존 GLP-1 치료제와 같이 지방간 해소 효과뿐 아니라 혈당·체중 조절, 고지혈 등 다양한 대사성 질환을 동시에 개선할 수 있다는 점도 강점이다. 디앤디파마텍의 페길레이션 기술을 적용해 반감기를 증대시키면서 안전성과 내약성도 개선했다.
디앤디파마텍 관계자는 “연내 기술이전 계약 체결을 목표로 하고 있다”면서도 “(딜 사이즈에 대한) 목표치를 수치로 공개하는 건 부적절한 것 같다”고 말했다.






![문여정 IMM인베스트먼트 전무 "ADC·DDS·CNS 주목"[바이오 VC 집중조명⑩]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/02/PS26020600489b.jpg)
![LG화학도 탐냈던 AI신약개발사 히츠…"젊은 천재와 노련한 선장"[사제 공동창업]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/02/PS26020700165b.jpg)

