팜이데일리 프리미엄 기사를 무단 전재·유포하는 행위는 불법이며 형사 처벌 대상입니다.
이에 대해 팜이데일리는 무관용 원칙을 적용해 강력히 대응합니다.
[이데일리 김지완 기자] 27일 국내 바이오기업들이 글로벌 학회 초청, 신약 효능 입증, 책임경영 강화 등 굵직한 성과를 잇달아 내놓고 있다.
디앤디파마텍(347850)은 지방간염 치료제 임상 2상 결과가 미국간학회 ‘최신 혁신’ 세션에 선정돼 국제 학계의 주목을 받았다. 인트론바이오(048530) 신약은 코 속 황색포도상구균을 99.9% 제거하는 동물실험 결과를 확보하며 감염예방제 개발에 속도를 내고 있다. 코아스템켐온(166480)은 뉴로나타-알’의 임상 3상 톱라인 실패에도 불구 양길안 대표가 17억원 규모의 자사주 매수를 결정해 시장 관심이 집중됐다.
디앤디파마텍, “지방간염 줄이는 신약 효과 입증” 디앤디파마텍 신약이 지방간염 감소에 성공했다는 소식에 급등세를 시현했다.
디앤디파마텍이 개발 중인 대사이상 관련 지방간염(MASH) 치료제 ‘DD01’의 임상 2상 결과가 미국간학회(AASLD) 연례학술대회에서 ‘최신 혁신’(Late-Breaking Abstract) 세션 발표로 선정됐다. 이 세션은 세계 간질환 연구 분야에서 가장 주목받는 무대로, 후기 임상 단계에서 임상적 혁신성과 데이터 신뢰성을 동시에 인정받은 연구만이 초청된다. 국내 기업이 이 세션에 선정된 것은 매우 이례적이다.
이날 KG제로인 엠피닥터에 따르면, 큐리언트는 전날 대비 14.79%(2만 4900원) 상승한 19만 3300원으로 거래를 마쳤다.
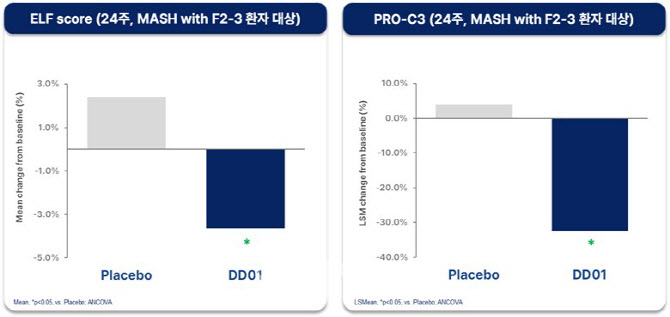 | | DD01 24주차 투약군과 대조군의 섬유화 관련 바이오마커(ELF Score) 비교 (자료=디앤디파마텍) |
|
MASH(대사이상 관련 지방간염)은 비만, 당뇨, 고지혈증 등으로 인해 간에 지방이 과도하게 쌓이고 염증이 생기는 질환이다.
초기에는 증상이 거의 없지만, 시간이 지나면 간섬유화 → 간경변 → 간암으로 이어질 수 있다. 전 세계적으로 환자가 급증하고 있으며, 아직 승인된 치료제가 없는 ‘미충족 수요’질환으로 꼽힌다.
DD01은 GLP-1(글루카곤 유사 펩타이드-1)과 글루카곤 수용체를 동시에 겨냥하는 ‘이중 작용제’다.
GLP-1은 혈당을 낮추고 식욕을 줄여주는 호르몬으로, 최근 ‘GLP-1 비만 치료제’로 널리 알려졌다.
반면 글루카곤 수용체는 간에서 지방을 태우고 에너지를 소비하게 하는 역할을 한다.
현재 DD01은 미국에서 MASLD/MASH 환자를 대상으로 48주 투약 임상 2상이 진행 중이다.
앞서 공개된 12주차 중간 결과에서는 지방간 감소 효과를 빠르게 확인했고, 간 기능 개선을 평가하는 1차 평가지표도 충족했다.
이 같은 성과가 AASLD로부터 높은 평가를 받아, 학회의 핵심 세션에서 구두 발표로 다뤄지게 된 것이다.
발표는 휴스턴 메소디스트 병원의 마젠 누레딘(Mazen Noureddin) 교수가 맡는다. 그는 이번 임상의 주요 책임자(PI)이자, 글로벌 MASH 연구의 세계적 권위자로 알려져 있다.
그는 앞서 마드리갈의 레즈메티로임(Resmetirom), 89바이오의 페고자퍼민(Pegozafermin), 아케로의 에프룩시퍼민(Efruxifermin) 등 글로벌 신약 후보 50여 건의 임상에 참여한 바 있다.
이슬기 디앤디파마텍 대표는 “AASLD의 ‘최신 혁신’ 세션 초청은 DD01의 임상 데이터와 과학적 완성도를 세계적으로 인정받은 결과”라며 “세계 최고 권위자인 누레딘 교수의 발표를 통해 DD01의 기술력이 글로벌 시장에서도 확고히 자리 잡을 것으로 기대한다”고 말했다. 이어 “이번 기회를 계기로 기술이전 협의와 후속 임상 진전을 가속화해 MASH 치료제 경쟁력을 높이겠다”고 덧붙였다.
인트론바이오, “코 속 세균 99.9% 제거” 인트론바이오가 개발 중인 신약 SAL200(INT-214)이 코 속에 서식하는 황색포도상구균을 거의 완전히 없애는 데 성공했다. 이번 동물실험 결과로 회사는 수술 전 환자의 감염을 예방하기 위한 ‘비강 제균제’ 개발에 한층 속도를 낼 계획이다.
이날 인트로바이오는 전날보다 300원(8.70%) 오른 3750원으로 장을 마감했다.
황색포도상구균(Staphylococcus aureus)은 건강한 사람의 코나 피부에도 흔히 존재하는 세균이지만, 면역력이 떨어지거나 상처 부위에 침투하면 패혈증·폐렴·심내막염 등 심각한 감염증을 일으킬 수 있다. 특히 수술 환자에게는 2차 감염의 주요 원인으로 꼽힌다.
 | | 인트론바이오 CI (사진=인트론바이오) |
|
인트론바이오는 이번에 외부 전문기관과 함께 ‘비강 내 황색포도상구균 제균 효과 시험(Proof of Concept)’을 진행했다. 사람과 호흡기 구조가 비슷한 ‘목화쥐(cotton rat)’를 이용해 코 안에 세균을 집락시키고, SAL200을 다양한 농도로 투여해 효과를 관찰했다.
그 결과, 약을 투여한 모든 실험군에서 세균이 눈에 띄게 감소했으며, 가장 낮은 농도에서도 98.9%의 제균 효과를 보였다. 고농도에서는 세균이 완전히 사라지는(멸균) 수준의 효과를 확인했다.
또한 실제 임상에서 사용할 예정인 ‘면봉으로 코 안에 바르는 방식’에서도 99.9%의 세균 제거 효과가 나타났다.
인트론바이오는 이번 데이터를 토대로 SAL200의 적절한 투여량과 사용법을 확정한 뒤, 연내 임상시험계획(IND)을 제출할 방침이다.
전수연 생명공학연구소 본부장은 “SAL200의 강력한 제균 효과와 임상 적용 기준을 확보했다”며 “임상시험을 위한 자료를 정리해 올해 안에 계획서를 제출할 예정”이라고 말했다.
그는 “SAL200은 코 속 황색포도상구균을 효과적으로 제거해 수술 후 감염 등 2차 감염 위험을 크게 낮출 수 있다”고 덧붙였다.
윤경원 대표는 “SAL200은 이미 심내막염 모델에서 치료 효과가 검증된 약물”이라며 “이번 비강 제균 효능 평가를 통해 광범위한 항균 효과가 다시 한번 확인됐다”고 설명했다.
이어 “SAL200을 통해 항생제 내성(AMR) 문제 해결과 황색포도상구균 감염 예방에 새로운 대안을 제시했다”고 강조했다.
코아스템켐온, 임상 3상 톱라인 실패에도, 자사주 매수? 코아스템켐온은 뉴로나타-알(Neuronata-R) 임상 3상 톱라인 실패에도 불구, 대표이사 개인 자금으로 대규모 자사주 매입에 나선다는 공시에 시장 관심이 모였다.
이날 코아스템켐온은 양길안 대표이사는 약 17억원 규모의 자사주를 장내 매수할 예정이라고 공시했다. 코아스템켐온은 직전 거래일보다 124원(7.38%) 오른 1804원의 종가를 기록했다.
양길안 대표는 “뉴로나타-알(Neuronata-R) 임상 3상 성과와 글로벌 허가 가능성을 확인하면서 회사의 성장 잠재력에 대한 확신이 더욱 커졌다”며 “경영자로서 기업 비전과 주주 신뢰를 행동으로 증명하고자 장내 매수를 결정했다”고 밝혔다.
그는 이어 “이번 매수는 단순한 투자 판단이 아니라, 경영성과에 대한 자신감과 책임경영 의지를 직접 보여주는 행보”라고 강조했다.
뉴로나타-알은 세계 최초 상업적 투여형 루게릭병 줄기세포 치료제다. 정확하게는 근위축성측삭경화증(ALS, 루게릭병) 환자를 위한 자가 골수유래 중간엽줄기세포(MSC) 치료제다.
환자의 골수에서 줄기세포를 채취해 배양·정제한 뒤 다시 척수강(intrathecal space)에 주입하는 방식으로, 신경세포 주변의 염증 반응을 줄이고 신경세포의 생존을 돕는 기전으로 작용한다.
면역거부반응 위험이 거의 없고, 장기 투여에서도 안정적인 안전성 프로파일이 확인됐다.
이 치료제는 2014년 국내 식품의약품안전처로부터 조건부 품목허가를 받은 이후, 실제 임상현장(real-world)에서 400명 이상 환자에게 상업적으로 투여됐다.
지난 10여 년간 축적된 데이터를 바탕으로 코아스템켐온은 현재 다국가 무작위대조 임상 3상(ALSUMMIT, NCT04745299)을 진행 중이며, 미국과 한국을 포함한 글로벌 허가 절차를 준비하고 있다.
뉴로나타-알은 지난해 12월 초기 3상 톱라인 결과에서는 전체 환자군에서 통계적 유의성을 확보하지 못했다고 발표했다. 다만, 코아스템켐온은 병의 진행이 느린 환자군(subgroup)에서는 운동 기능(ALSFRS-R)과 생존기간 개선이 관찰돼, 회사는 FDA 가속승인(accelerated approval) 전략을 검토하고 있다.
코아스템켐온 관계자는 “이번 조치들은 단기적인 주가 부양 목적이 아니라, 중장기적인 기업 경쟁력 강화와 투자자 신뢰 회복을 위한 전략적 결정”이라고 설명했다.












