팜이데일리 프리미엄 기사를 무단 전재·유포하는 행위는 불법이며 형사 처벌 대상입니다.
이에 대해 팜이데일리는 무관용 원칙을 적용해 강력히 대응합니다.
[이데일리 석지헌 기자] HLB(028300)가 영국계 글로벌 자산운용사로부터 대규모 투자를 유치하면서 간암 신약 허가에 대한 신뢰를 확보했다는 평가가 나온다. 동시에 투자자인 LMR 파트너스는 수익 가능성은 열어두면서 손실 위험은 최소화한 방어형 투자 구조를 설계한 것으로 해석된다.
 | | [이데일리 이미나 기자] |
|
국내 두 번째…“재승인 신뢰 확보” 5일 제약·바이오 업계에 따르면 글로벌 자본이 경영권 인수 목적이 아닌 단순 투자를 위해 한국 바이오 기업에 한 사례는 2010년 싱가포르 국부펀드 테마섹(Temasek)의 셀트리온 투자 이후 처음이다. 테마섹은 2010년과 2013년 두 차례에 걸쳐 셀트리온그룹에 4000억 원을 투자해 8년 만에 20배 가까운 평가이익을 거뒀다. 국내 기관들이 외면하던 시기에 글로벌 자본이 기술력을 먼저 인정한 사례였다.
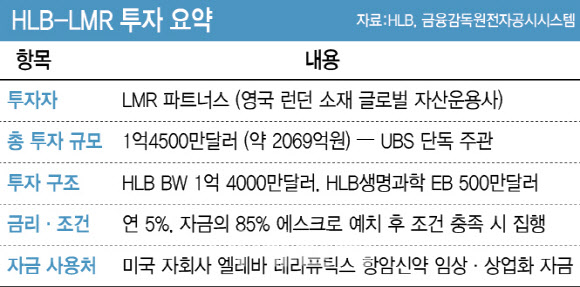
영국 런던에 본사를 둔 글로벌 자산운용사 LMR 파트너스는 지난 3일 HLB그룹에 총 1억4500만 달러(약 2069억 원) 규모 투자를 단행했다. HLB 본사에는 1억4000만 달러 규모의 신주인수권부사채(BW)를, HLB생명과학에는 500만 달러 규모의 교환사채(EB)를 각각 인수하는 형태로 투자했다. 이번 거래는 글로벌 투자은행 UBS가 단독으로 주관했다.
이번 투자는 글로벌 자본이 HLB의 신약개발 역량과 상업화 가능성을 다시 평가한 결과로 풀이된다. 특히 간암 1차 치료제 ‘리보세라닙+캄렐리주맙’ 병용요법이 미국 식품의약국(FDA) 재심사 단계에 있는 시점에서 이뤄진 만큼 재승인에 대한 신뢰도를 확보했다는 평가가 나온다.
한 신약 개발 기업 IR 담당 임원은 “LMR의 운용자산 규모가 17조원 수준인데 여기서 2000억원을 투자한 건 적은 규모가 아니다”라며 “그만큼 성공 가능성을 높게 보고 한 게 아닐까 생각한다. 물론 투자자 입장에서도 실패해도 연 이자 5%를 받기 때문에 안전장치는 마련한 것”이라고 말했다.
수익 무한대, 손실은 제한적 HLB가 이번에 발행한 BW는 연 5% 단일금리로, 과거 국내 기관투자자를 대상으로 발행했던 0.01%대 무이자 전환사채(CB)보다 조달비용이 높다. 실제 지난해 3월과 7월 각각 600억원과 330억원 규모로 발행한 제38·39회 전환사채는 표면이자율 0.01% 수준의 사실상 무이자 채권이었다.
동시에 이번 투자는 자금의 85%를 해외 에스크로 계좌에 예치해 일정 조건이 충족돼야만 집행되도록 설계됐다. 즉 신약 허가나 임상 진척이 지연될 경우 투자금 대부분이 보호되는 구조다. 반대로 FDA 승인 등 가치상승 이벤트가 발생하면 자금이 바로 풀리면서 HLB의 자금 활용 효율이 높아지는 구조다.
풋옵션은 3년 이후부터 행사 가능하며, HLB의 주가가 전환가(4만8917원)의 115% 이상이 되면 강제 전환(Call Option)이 발동된다. 단기 상환 부담은 줄이면서도, 주가가 상승할 경우 투자자가 수익을 극대화할 수 있는 ‘조건부 수익형’ 구조다.
특히 전환가가 기존 CB(5만5000원대)보다 낮은 4만8917원으로 설정돼 있어, HLB 주가가 이를 넘으면 LMR은 전환만으로도 차익을 얻게 된다. 반면 HLB는 주가가 상승할수록 자본전환을 통한 부채 축소 효과를 기대할 수 있다.
HLB 관계자는 “이번 거래는 HLB그룹 창사 이래 첫 해외 자본 유입으로, 그룹이 추진해온 혁신 신약 개발의 잠재력을 해외 시장에서 인정받은 결과”라며 “이 자금을 기반으로 핵심 파이프라인의 글로벌 허가와 시장 진출을 가속화해 기업가치 상승으로 이어가겠다“고 말했다.
HLB는 조달 자금을 미국 자회사 엘레바 테라퓨틱스에 투입해 리보세라닙과 리라푸그라티닙 등 주요 파이프라인의 임상 개발 및 글로벌 상업화를 추진할 계획이다.
리보세라닙은 지난 3월 미국 식품의약국(FDA)으로부터 두 번째 보완요청서(CRL)를 받았다. FDA가 공개한 CRL 원문에 따르면 항서제약의 캄렐리주맙에 대한 CMC(제조·품질관리) 관련 결함이 언급됐다.
HLB와 항서제약은 추가 자료 확보 등을 거쳐 연내 재신청을 목표하고 있다. 신약 허가 재신청 이후 클래스1(Class1)으로 분류될 경우 2개월 안에 심사가 완료되고, 클래스2(Class1)를 받으면 6개월 내 심사를 받을 수 있다.









