팜이데일리 프리미엄 기사를 무단 전재·유포하는 행위는 불법이며 형사 처벌 대상입니다.
이에 대해 팜이데일리는 무관용 원칙을 적용해 강력히 대응합니다.
[이데일리 이광수 기자]
파멥신(208340)이 올해 적극적인 임상 파이프라인 확장에 나선다. 전임상 단계에 머물러 있던 파이프라인 2건을 올해 임상 단계에 진입시킨다. 다만 시장의 의구심이 크다. 파멥신은 지난 2008년 설립돼 올해로 설립 16년 차를 맞은 국내 1세대 바이오다. 이렇다 할 매출이 없는 바이오테크로 임상 단계 진입과 데이터가 가장 중요하지만, 경쟁 바이오테크들에 비해 지금껏 뚜렷한 임상 성과를 보여주지 못한 탓이다.
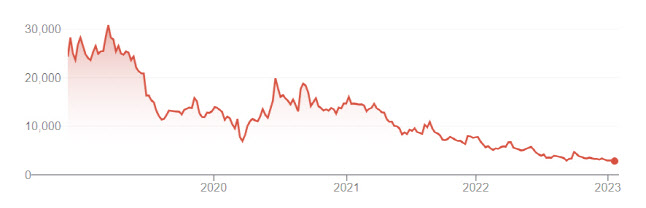
임상중인 파이프라인 1개 현재 파멥신을 이끌고 있는 것은 전이성 삼중음성유방암(mTNBC)을 적응증으로 개발중인 ‘올린베시맙(옛 타니비루맵)’과 머크의 ‘키트루다’ 병용임상이다. 이날 기준으로 파멥신이 갖고 있는 유일한 임상단계 파이프라인이다. 보유 기술이 우수하다는게 업계의 평가이지만, 임상 진행 상황만 놓고 본다면 아직 초기 바이오테크와 큰 차이가 없다.
해당 임상은 지난 2021년 9월에 호주 임상2상 승인을 받았지만 이날 현재 mTNBC 임상은 약 25% 정도 완료됐다. 매출을 위한 신규사업 등에 한눈팔지 않고 연구개발만 한 바이오테크임에도 결과적으로 속도 측면에서는 시장의 눈높이에 미치지 못했다. 임상 전문기업 관계자는 “환자 모집이 쉽지 않을 것”이라고 평가했다.
임상 1b상 중간데이터도 지난 2020년 9월에 공개됐지만, 최종 데이터는 그로부터 2년 4개월이 지난 이달 말 발표가 예정돼 있다. 다행인 점은 임상 1상 중간 결과 값이 긍정적으로 평가된 점이다. 중간 데이터 발표에서 고용량군(16mg/kg)에서 객관적반응률(ORR)50%, 질병통제율(DCR) 67%을 보였다. 파멥신 관계자는 “최종 데이터도 이와 크게 다르지 않을 것”이라고 말했다.
 | | 조기종료된 파멥신 파이프라인 현황 (자료=파멥신) |
|
객관적 반응률은 전체 환자 대비 종양 크기 감소 등의 객관적인 반응을 확인할 수 있는 환자의 비율을 뜻한다. 질병통제율은 암세포의 성장이 멈추거나 크기가 줄어든 비율을 의미한다.
자진철회 하는 동안 주가는 내리막 여기에 진행 중이던 파이프라인을 자진 철회하거나, 조기종료 하면서 주가 상승 모멘텀을 억눌렀다. 2018년 상장 이후 주가 수익률은 마이너스(-)88%다.
파멥신은 처음에는 올린베시맙 단독 임상을 진행했다. 지난 2011년~2013년 난치성 고형암 환자를 대상으로 올린베시맙 단독 국내 임상1상을 진행했지만 안전성 문제가 지적됐다. 결국 국내 임상2a을 자진철회한 파멥신은 그 이후 호주·미국 등에서 재발성교모세포종 환자를 대상으로 임상2a상을 시작해 2017년 9월이 돼서야 마무리했다. 하지만 약 5년 뒤인 2022년 임상 조기종료를 결정했다. 회사 측은 “전략적인 이유”라고 밝혔다.
그 이후 파멥신은 키트루다 병용임상에 집중하게 된다. 다만 mTNBC와 함께 호주에서 임상1상을 진행한 재발성 뇌종양(rGBM)을 적응증으로 한 파이프라인은 임상 2상을 진행하지 않기로 했다. 1차 지표인 안정성 등은 확인됐지만 mTNBC 적응증처럼 효과적인 데이터를 얻지 못했기 때문으로 풀이된다.
파멥신은 마땅한 매출처가 없는 바이오테크다. 지난 2021년 매출은 6800만원, 영업손실은 382억9000만원으로 각각 집계됐다. 임상으로 인한 개발비 등으로 손실폭은 매해 더 커지는 모양새다. 투자자의 우려는 자금력이다. 파멥신 관계자는 “자금 이슈를 잘 파악하고 있고 최대한 연구개발에 비용을 투입하는 등의 관리를 하고 있다”고 답했다.
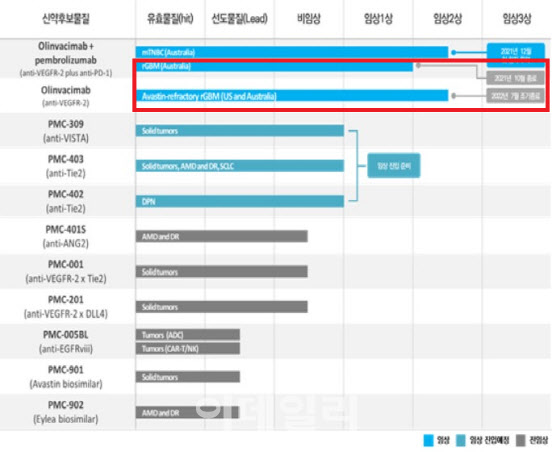 | | 상장 이후 파멥신 주가 추이 (자료=구글 파이낸스)(단위=원)*기준=1월19일 |
|
올해 비임상 파이프라인 2개 임상 진입 이날 제약·바이오 업계에 따르면 파멥신은 올해 두 개의 비임상 파이프라인의 임상 단계를 밟게 된다. 아직 임상시험계획서(IND)는 제출하지 않았지만, 임상 진입이 예정된 파이프라인은 ‘PMC-309’다. 파멥신 관계자는 “호주 임상1상 진입 준비가 완료됐고, 프로토콜을 최종적으로 정리중”이라며 “호주 인체연구윤리위원회(HREC)에 상반기 안에 제출해서 승인을 받을 것”이라고 말했다.
PMC-309는 면역억제에 관여하는 면역관문 단백질인 ‘VISTA’와 결합해 면역세포를 활성화하는 면역항암제다. 앞서 진행된 동물 임상에서 단독 투여할 경우와 항PD-1 면역항암제와 병용투여시 모두 항암 효과가 확인됐다는게 회사의 설명이다.
임상 1상이지만 키트루다와 병용으로 진행되는 것이 특징이다. 파멥신 관계자는 “최근 면역항암제는 병용임상으로 가는 개발 전략을 많이 채택하고 있다. 비스타를 타겟하는 후보물질이 1상에서부터 병용으로 진행하는 경향이 있다”며 “머크와는 키트루다를 무상으로 제공하기로 협의가 돼 있어 1상부터 병용투여를 하게 된 것”이라고 설명했다.
황반변성 치료제로 개발 중인 ‘PMC-403’도 연내 임상 진입이 예정돼 있다. 지난해 12월 파멥신은 식품의약품안전처에 PMC-403 임상 1상 IND를 신청했다.
파멥신은 2008년 글로벌 빅파마인 ‘노바티스’로부터 초기 투자를 받으면서 업계에 이름을 알렸다. 올린베시맙의 가능성을 높게 평가받아서다. 지난해 말 기준 최대주주인 유진산 파멥신 대표의 지분은 5.23%다. 유일한 5% 이상 소유 주주다. 소액주주 보유 지분율은 91.65%다.








!['2% 로열티'가 무너뜨린 신뢰…알테오젠發 바이오株 동반 하락[바이오맥짚기]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/01/PS26012201091b.jpg)

