[이데일리 석지헌 기자] 정부가 혁신의료기기 평가 기간을 5분의 1 수준으로 줄이겠다고 발표했다. 고강도 인력 감축이 추진되는 상황에서 다소 파격적으로 심사 기간을 단축한다는 내용에 업계는 기대보다는 우려의 목소리가 나온다.
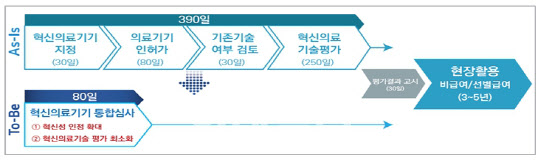
복지부는 지난달 27일 대통령 주재로 열린 ‘제4차 비상경제민생회의’에서 바이오헬스 규제 혁신안을 내놨다. 이 혁신안에는 혁신의료기기가 의료 현장 진입에 필요한 평가 기간을 기존 390일에서 80일로 대폭 줄인다는 내용이 담겼다.
혁신의료기기 지원 사업은 새로운 기술로 만들어진 의료기기 중 혁신성과 안전성, 사업성 등을 인정받은 기기가 빠르게 상업화되도록 돕는 제도다.혁신의료기기로 지정되면 제품 개발을 하면서 식약처 허가 과정도 함께 진행할 수 있다. 일반 의료기기는 제품 개발을 끝낸 후 허가 절차에 들어갈 수 있는데 혁신의료기기는 동시에 하기 때문에 시장에 내놓기까지 걸리는 시간이 크게 줄어든다.
혁신의료기기 평가에는 보건복지부와 식품의약품안전처, 건강보험심사평가원, 한국보건의료연구원, 보건산업진흥원이 참여한다. 해당 기기의 제품군을 분류하는 역할은 복지부가, 혁신의료기기 지정과 의료기기 인허가를 담당하는 업무는 식약처가 각각 담당한다. 이 단계까지 소요되는 기간이 110일 정도다. 이후 심평원이 기존 기술 여부 검토 기간이 30일, 혁신의료기술 평가 기간이 250일 정도 걸린다. 이를 모두 더하면 390일이다.
혁신안에 따르면 혁신의료기기 심사 중 가장 마지막 단계이자, 시간이 가장 많이 걸리는 혁신의료 기술평가 과정(250일)을 앞으로 빼, 핵심 부분만 통합해 심사하기 때문에 평가기간을 크게 줄일 수 있다.
 | | 인공지능·디지털 혁신 의료기기 규제개선안.(자료= 보건복지부) |
|
하지만 정작 혁신의료기기 심사를 준비 중인 의료기기 업체들은 기대보다는 우려를 표한다. 새정부가 고강도 인력 감축을 추진하는 상황에서 현실적으로 심사 과정이 얼마나 효율적으로 줄지 알기 어렵다는 지적이다.
의료기기를 개발하는 A 업체 관계자는 “안 그래도 식약처와 심평원은 만성적인 인력 부족에 시달리는데 심사 과정이 구체적으로 어떻게 단축되는 것인지, 실제 단축이 될 수 있는 건지 의문이 든다”며 “심사 인력이 부족한 상황에서 다수의 업체들이 동시에 심사를 받는다. 그 과정에서 서류 보완이 뜨면 더 오래 걸린다. 심사는 빠르게 하는데 심사 인력은 줄이는 상황이 잘 이해가 되지 않는다”고 말했다.
또 다른 B 업체 관계자는 며 “혁신의료기술을 이해하려면 신기술을 이해할 수 있는 심사 인력이 필요하다. 통합 심사라는 게 인력 충원을 한다는 건지, 인력 충원도 어려울텐데 어떻게 가능한건지 의문”이라고 말했다.
복지부 관계자는 “아직 세부 실행에 관한 내용은 준비 중”이라며 “제도 개선에 있어 인력이 필수 요소는 아니다. 얼마나 업체들 신청이 들어올지 예측할 수 없는 상황이라, 세부 실행에 관한 내용이 확정되면 인력 등이 어느 정도 필요한지 파악할 수 있을 것이고 기존 인력들로도 효율적으로 제도를 운영하도록 개선해 오고 있다”고 말했다.
혁신의료기기로 지정된 후 시장 진입 등에 있어 지금보다 더 나은 혜택들이 제공돼야 한다는 지적도 나온다. 현재는 혁신의료기기로 지정돼도 식약처와 빠르게 소통할 수 있다는 것 외에는 큰 장점이 없다는 것.
혁신의료기기 지정을 받은 C 업체 관계자는 “사실 실질적인 혜택은 거의 없다고 본다”며 “식약처 허가를 받더라도 시장 진입에 여전히 어려움을 겪는 업체들도 많다. 그러다 보니 한정된 인력이나 시간을 서류 작업에 쓸 것이 아니라 제품 성능 개선에 집중하는 것이 낫다고 보는 곳도 있다”고 말했다.
실제 미국의 경우 혁신의료기기 지정 제품은 2016년부터 2021년까지 317건이고 이 가운데 28건이 FDA(미국 식품의약국) 승인을 받았다.
중국은 2014년부터 2021년 10월까지 350개 제품이 중국 국가의약품감독관리국(NMPA)을 통해 혁신의료기기 특별승인절차에 지정됐다. 이후 연간 50건 내외 제품이 신규로 지정되고 있다. NMPA 승인을 받은 제품은 지난해 6월 기준 98건이다.
반면 우리나라는 혁신의료기기 지원 사업이 시작된 지난 2020년부터 현재까지 신청 건수는 103건이고, 이 중 19개가 혁신의료기기로 지정됐다. 해외보다 운영 기간이 짧다는 점을 감안해도 적은 수준이다.







![알테오젠, 일시적 투심하락 관망세 전환…삼양바이오팜 가파른 상승[바이오맥짚기]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/01/PS26012300239b.jpg)

