팜이데일리 프리미엄 기사를 무단 전재·유포하는 행위는 불법이며 형사 처벌 대상입니다.
이에 대해 팜이데일리는 무관용 원칙을 적용해 강력히 대응합니다.
[이데일리 김지완 기자]
엔케이맥스(182400)의 자연살해(NK)세포 치료제 ‘수퍼NK’가 불치병으로 불리던 질환에서 치료 효과를 내면서 기업 가치가 재평가되고 있다.
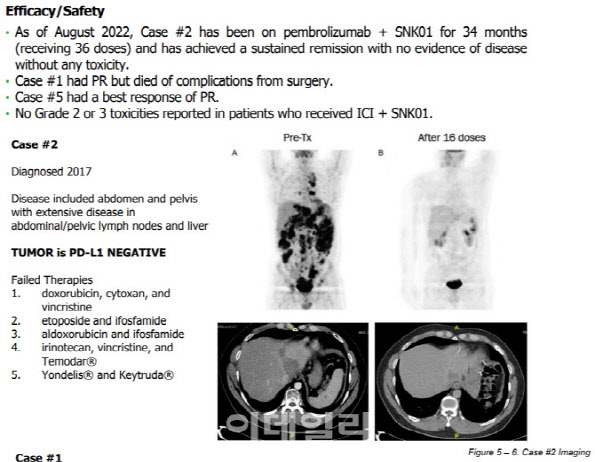 | | 유럽종양학회(ESMO) 2022 포스터에 공개된 엔케이맥스 NJ세포치료제 ‘SNK’와 머크 키트루다 병용투여에서 34개월 간 완전관해(CR)을 유지하고 있는 환자 보고서. (제공=ESMO) |
|
2일 관련 제약·바이오업계에 따르면 엔케이맥스는 수퍼NK를 기반으로 불응성 비소세포폐암, 육종암, 알츠하이머 등 고형암에서부터 신경퇴행성 질환까지 5종 적응증을 타깃으로 하는 임상 파이프라인을 보유 중이다.
엔케이맥스는 2002년 설립된 NK세포 기반 면역세포치료제 개발 바이오기업이다. 선천면역 세포인 NK세포는 체내에 약 5~15%로 아주 적게 존재해 치료제로 사용하기엔 수가 적다. 엔케이맥스는 차별화된 기술로 NK세포를 대량생산하고 활성도를 높였고 이를 수퍼NK로 명명했다.
육종암 환자, 43개월째 재발 없어 현재까지 성과만 놓고 보면 엔케이맥스는 킴리아·예스카다 등의 CAR-T 치료제를 뛰어넘을 만한 잠재력을 가졌다는 평가다. 자사 NK세포치료제 ‘SNK’와 키트루다 병용투여로 완전관해(CR) 판정을 받은 미국인 32세 육종암 환자가 43개월째 암이 재발하지 않고 있다. 이 기간 해당 환자는 총 47차례 ‘SNK+키트루다’를 투약했다. 이 환자는 지난 2017년 전이성 육종암 진단을 받았다. 암세포는 복부·골반 림프절 및 간에 광범위하게 전이돼 있었다. PD-L1 음성으로 키트루다·옵디보 같은 면역항암제도 전혀 듣지 않았다.
이 환자는 SNK+키트루다 처방 전 5차례에 걸쳐 다른 약물을 투약했으나 모두 실패로 돌아갔다. 구체적으로 1차 닥서루비신·사이탁산·빙크리스틴, 2차 이타퍼사이드·이포스파미드, 3차 알독소루비신·이포스파미드, 4차 아이리노테칸·빙크리스틴·테모달, 5차 얀델리스·키트루다 순이다.
엔케이맥스 관계자는 “이 환자는 더 이상 쓸 약이 없던 상황”이라면서 “미국 현지 의사가 FDA(식품의약국)에 치료목적으로 ‘SNK+키트루다’ 동정적 사용 승인을 받아 투약한 것”이라고 설명했다. 이어 “이 환자 몸 전체 퍼진 암세포가 ‘SNK+키트루다’ 16차례 투약 후 말끔이 사라졌다”면서 “이후 주기적으로 투약을 이어가고 있고 3년간 완전관해를 유지하고 있다”고 강조했다.
이번에 FDA에 동적적 사용승인을 신청한 의사는 현재 미국 육종암센터에 근무 중으로 키트루다·바벤시오와 SNK 병용투여 미국 임상 1상에 참여 중이다. 이 의사는 SNK 병용투여 임상에서의 좋은 결과를 목격하고 임상과 별개로 사망 직전의 8명의 환자를 FDA에 등록하고 투약을 결정했다.
주목할 점은 지금껏 개발된 치료제 가운데 고형암에서 이 같은 효능을 보여준 전례가 없다는 것이다. 특히 이 암 환자는 모든 치료제에 불응했고 사망 직전의 상태였다. 하지만 엔케이맥스의 NK세포치료제를 투약하고 기사회생했다. 높은 효능으로 주목받고 있는 CAR-T는 적응증이 혈액암에 국한돼 있다. 전체 암에서 고형암이 95%를 차지하고 혈액암 비율은 5%에 불과하다.
엔케이맥스는 지난해 육종암 임상 1상 병용투여군 15명의 중간 데이터를 발표했다. 구체적으로 완전관해(CR)1명, 부분관해(PR) 1명, 안정병변(SD) 8명을 각각 기록했다. 엔케이맥스는 현재 육종암 임상 1상을 마무리하고 최종 결과 분석 중이다.
 | | 알츠하이머협회 국제회의(AAIC 2023)에서 폴송 엔케이젠바이오텍(미국법인) 대표이사가 발표 중이다.(제공=엔케이맥스) |
|
알츠하이머에도 치료 효과 멕시코에서 진행된 10명의 알츠하이머 환자에 대한 수퍼NK 임상 중간 1상 결과에서 7명의 환자로부터 인지력 개선이 확인됐다. 특히 마지막 투약 후 12주 뒤에도 개선된 인지력이 유지됐다. 엔케이맥스는 이 같은 결과를 지난달 네달란드 암스테르담에서 열린 ‘알츠하이머협회 국제회의’(AAIC 2023)에서 발표했다.
엔케이맥스 관계자는 “3가지 인지력측정 지표에서 적게는 5명, 많게는 7명까지 인지력이 개선됐다”며 “수퍼NK 투약 후 뇌척수액의 바이오마커와 신경염증의 개선이 보였다”고 말했다.
이어 “약 70% 알츠하이머 환자가 용량 증가에 따라 인지능력 개선 및 안정화 효과가 유지되는 경향을 보였다”면서 “수퍼NK가 저용량에서도 충분히 효과적인 알츠하이머 치료제다. 고용량 치료 시 더욱 긍정적인 장기 치료결과를 기대할 수 있는 의미”라고 강조했다.
미국 식품의약국(FDA)는 올해 1월 수퍼NK를 알츠하이머 환자를 대상으로 동정적 사용승인을 했다. 동정적 사용승인은 의사가 자신의 환자 치료를 목적으로 임상 중인 약물에 대해 FDA에 사용허가를 얻는 절차다. 대게 동정적 사용 승인은 더이상 사용 가능한 치료제가 없어 치료를 포기할 상황에 이를 경우 의사 판단 아래 이뤄지는 절차다.
알츠하이머·파키슨병은 지금까지 증상완화제는 있어도 치료제는 없었다. 하지만 수퍼NK는 난공불락으로 여겨지던 질환들에서 약 효능을 입증하고 있는 것이다.
한편 엔케이맥스는 미국과 한국에 cGMP(FDA 인증 우수의약품 관리 및 제조) 시설을 보유하고 있어 임상에 필요한 수퍼NK를 자체적으로 생산할 수 있다. 엔케이맥스는 자가·동종 NK세포 모두 8만~40만 도즈 이상 대량 생산이 가능하다.





![이혁준 서울대병원 교수 "암환자 식단관리앱 힐리어리 예후 바꿀 첫 도구 "[전문가 인사이트]](https://image.edaily.co.kr/images/vision/files/NP/S/2025/12/PS25121100299b.jpg)
!['상장 첫날 시총 2.8조' 에임드바이오, 코스닥 다크호스 급부상 [바이오맥짚기]](https://image.edaily.co.kr/images/vision/files/NP/S/2025/12/PS25120500172b.jpg)