팜이데일리 프리미엄 기사를 무단 전재·유포하는 행위는 불법이며 형사 처벌 대상입니다.
이에 대해 팜이데일리는 무관용 원칙을 적용해 강력히 대응합니다.
[이데일리 김새미 기자]
샤페론(378800)의 코로나19 폐렴 치료제 ‘누세핀(NuSepin)’ 임상 2b상 결과, 분석군에 따라 P값의 통계적 유의성 달성 여부가 엇갈리면서 개인투자자들이 혼란스러워하고 있다. 임상 전문의들은 이번 임상 결과를 누세핀의 약효가 ‘애매하다’는 의미로 받아들이고 있다.
분석군에 따라 P값의 통계적 유의성 충족 여부 달라져 샤페론은 18일 누세핀의 임상 2b상 결과를 공시했다. 해당 임상은 지난해 8월부터 국내와 불가리아 등 전 세계 5개국에서 코로나19 폐렴으로 입원한 중증 이상의 환자 174명을 대상으로 진행됐다. 샤페론은 임상 3상에서 적용할 정맥투여의 용법 용량을 결정하기 위해 누세핀을 0.2mg/kg, 0.4mg/kg 투여한 시험군1, 시험군2와 대조군(위약군)으로 나눠 임상을 실시했다.
해당 임상의 1차평가지표는 시험약 투여 이후 세계보건기구 8점 서열척도(WHO 8-point ordinal scale, 이하 WHO 8-OS)에서 2점 감소하는데 걸리는 기간으로 설정됐다. WHO 8-OS란 코로나19 환자의 질환개선 정도를 0점(정상)~8점(사망)으로 분류한 것이다. 샤페론은 이 중 자가 호흡이 어려운 4~5점에 해당하는 환자를 대상으로 누세핀 임상 2b상을 진행했다. 4점은 저유량 보조산소장치, 5점은 고유량 산소장치에 의존하는 상태로 코로나19 중등증 환자에 속한다.
이날 샤페론의 공시에 따르면 누세핀 임상 2b상 결과 FA 평가군(full analysis set)에서 시험군1은 평균 8.56일, 시험군2는 평균 7.53일, 대조군은 평균 9.18일로 나타났다. 3그룹을 비교했을 때 P값이 0.1138로 통계적으로 유의한 차이를 확인하지 못했다. 반면 PP 평가군(per protocol set)에서는 시험군1은 평균 8.59일, 시험군2는 평균 7.33일, 대조군은 평균 9.15일로 P값이 0.0173로 확인됐다. 통상적으로 1차평가지표의 P값이 0.05 미만이면 성공(Pass)적인 임상이라고 판단한다. 해당 임상 결과는 분석군에 따라 P값의 통계적 유의성 충족 여부가 갈렸다.
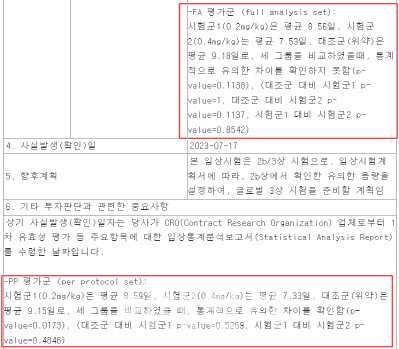 | | 샤페론의 18일 공시를 살펴보면 결과값에는 1차평가변수로 FA 평가군의 P값이 기재돼 있고, 기타 투자판단과 관련한 중요사항에 PP 평가군이 추가적으로 첨부돼 있다. (사진=금융감독원 전자공시시스템) |
|
1차평가지표 PP군만 통계적 유의성 충족…“약효 애매한 셈” FA 평가군은 1회 이상 투약을 받았지만 임상 프로토콜을 엄격히 준수하지 않은 환자군, PP 평가군은 임상 프로토콜을 엄격히 준수한 환자군을 의미한다. 샤페론의 FA 평가군은 임상 환자수 전체인 174명이다. 이 중 고령, 비만, 신장·간 기능 저하 등 고위험군 23명을 제외한 151명이 PP 평가군으로 추려졌다.
일반적으로 1차평가지표 주분석군으로는 FA 평가군으로 설정하는 경우가 많다. 실제로 의약품이 시판될 경우 프로토콜을 제대로 준수하지 못하는 환자들도 있을 것을 감안해서다. 또 프로토콜 위반 정도가 심각한 경우에는 FA 평가군에서도 제외된다. 샤페론 역시 1차평가지표 주분석군을 FA 평가군으로 설정해뒀다.
따라서 이를 기준으로 봤을 때 누세핀의 임상 2a상은 1차평가지표가 통계적 유의성에 달성하지 못했다. 바이오업계 관계자는 “해당 임상이 성공했는지, 실패했는지에 대해서는 평가하기 어렵다”면서도 “미리 설정한 통계 분석에 대한 기준을 만족시키지 못했다면 회사 측에서 원하는 결과(성공적인 결과)가 나온 것은 아니다”라고 조심스럽게 말했다.
임상 결과 PP군의 P값만 통계적 유의성을 충족시킨 것은 약효가 경계선에 있기 때문이라는 게 업계 관계자의 중론이다. 한 임상 전문가는 “이 정도 임상 결과가 나왔다는 것은 약효가 애매하다는 것”이라고 평가했다.
다른 바이오업계 관계자는 “임상 2상의 경우 PP 평가군도 충분히 의미가 있을 수 있다”며 “PP군에서 유의적으로 데이터가 나왔다면 새로운 임상디자인으로 유효성을 입증하면 충분히 의미 있는 데이터가 나올 수 있다”고 설명했다.
샤페론 “환자수 부족한 탓…글로벌 임상 3상·기술이전 추진” 회사 측은 임상환자수가 적은데다 일부 임상시험실시기관(site)의 스크리닝 과정에서 오류가 겹치면서 이 같은 결과가 발생했다고 보고 있다. 샤페론 관계자는 “임상 사이트에서 스크리닝이 잘 되고, 임상시험수탁기관(CRO) 분석에 이상이 없을 것이라고 판단해 주평가군을 FA 평가군으로 설정해 임상을 진행했다”며 “통제가 잘 된 시험이라 생각했는데 일부 임상을 동유럽에서 실시하다 보니 스크리닝 과정에서 에러가 있었던 것 같다”고 말했다.
성승용 샤페론 대표는 “글로벌 제약사에 비해 임상 자금이 부족한 국내 제약·바이오기업이 환자수를 적게 모으면 임상에 참여한 의사가 조금만 실수해도 결과값에 큰 영향을 미친다”며 “PP 평가군에서 위약 대비 투약군의 유효성 차이가 통계적 유의성을 확보했다는 것은 환자수를 충분히 모집하면 일부 실수한 데이터도 희석되면서 FA 평가군에서도 통계적 유의성을 확보할 수 있다는 것을 의미한다”고 강조했다.
샤페론은 이번 임상 결과를 바탕으로 유의한 용량을 설정해 글로벌 3상을 진행할 계획이다. 누세핀의 용량은 0.4mg/kg로 정해질 가능성이 높다. PP 평가군에서 시험군2가 대조군 대비 임상적으로 유의한 변화를 확인했을 뿐 아니라 통계적으로도 유의한 차이를 보였기 때문(P값=0.0141)이다.
동시에 중국과 동남아시아, 남미 등에서 누세핀의 기술이전도 추진한다. 샤페론 관계자는 “라이선스 딜에서는 PP 평가군을 보는 경우가 많다고 들었다”며 “FA 평가군과 PP 평가군 결과가 동일하면 더 좋겠지만 현실적으로 그렇지 않은 경우도 있기 때문”이라고 귀띔했다.
한 바이오업계 관계자는 “FA 평가군 결과가 잘 안 나왔다고 해서 반드시 기술이전 논의가 어려워진다고 볼 순 없다”며 “PP 평가군 데이터만으로도 의미가 있고 회사의 의견이 충분히 수용 가능하다고 판단할 경우 기술이전이 이뤄질 수도 있다”고 봤다.





![이혁준 서울대병원 교수 "암환자 식단관리앱 힐리어리 예후 바꿀 첫 도구 "[전문가 인사이트]](https://image.edaily.co.kr/images/vision/files/NP/S/2025/12/PS25121100299b.jpg)
!['상장 첫날 시총 2.8조' 에임드바이오, 코스닥 다크호스 급부상 [바이오맥짚기]](https://image.edaily.co.kr/images/vision/files/NP/S/2025/12/PS25120500172b.jpg)


