[이데일리 김지완 기자]
큐라클(365270)이 임상 2상 파이프라인 다수 보유로, 신약 상업화 가능성이 한층 높아졌단 분석이다.
삼성증권은 28일 ‘큐라클, 임상 2상 파이프라인 다수 보유...신약 개발 가능성 상승’ 보고서를 냈다.
우선, 가장 기대를 모으고 있는 당뇨성 황반부종 및 습성 황반변성 치료제 CU06은 지난달 27일 ‘CU06’ 미국 임상 1상 결과를 공시했다. CU06 임상 1상에서 최대 용량에서도 독성이 나타나지 않았다.
구체적으로 CU06은 용량별 단회 투여 또는 반복 투여 후 약동학(PK) 및 안전성·내약성을 확인했다. CU06은 모든 용량에서 중대한 이상 반응이 없었다. 큐라클은 지난해 10월 프랑스 제약업체 ‘떼아’(Thea)와 1억6350만달러 규모의 CU06 기술이전 계약을 체결했다.
서근희 연구원은 “CU06은 연내 당뇨성 황반부종 환자 대상 임상 2a상 진입 예정”이라며 “임상 2a상은 오픈 라벨 방식으로 평가해 유효성 확인 후 글로벌 임상 2b상(이중 맹검)과 습성 황한변성 환자 대상 추가 임상 확장을 계획 중”이라고 말했다.
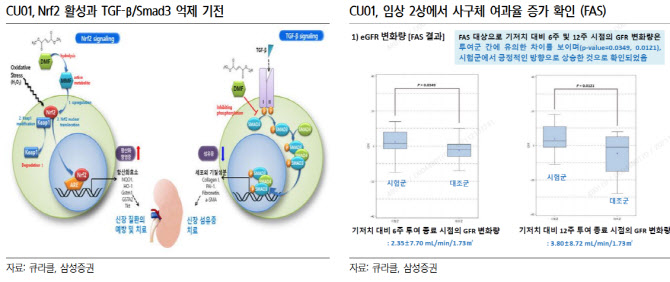
당뇨병서 신증 치료제 CU01 임상 재도전 일정도 구체화되고 있다. CU01은 지난 2월 식품의약품안전처(식약처)가 CU01 3상 임상시험계획(IND)을 반려했다. 그 결과, 큐라클은 임상 3상이 아닌 임상 2b상을 통해 CU01 임상을 이어갈 예정이다.
서 연구원은 “지난 4월 신청한 CU01 임상 2b상은 올 하반기 식약처 승인이 예상된다”며 “임상 3상이 아닌 임상 2b상 진입을 시장 발매 시점 지연은 아쉽다. 하지만 다양한 용량 및 세분화된 환자군에 대해 임상 2상에서 CU01 효과를 점검해 상업화 전략을 짜는 것도 중요할 것으로 판단된다”고 평가했다.
CU01의 임상 2a상은 투약군 20명과 대조군 20명 등 총 40명의 환자를 대상으로 진행됐다. 이 임상에서 CU01 투약군은 대조군 대비 사구체여과(eGFR) 지표에서 유효성을 입증했다.
CU01 임상 2b상에선 240명 환자를 늘리고, 240㎎, 360mg 등 두 가지 용량에서 효능을 확인할 계획이다. 아울러 미국 당뇨병성 신증 환자 대상 변경된 가이드라인에 따라 SGLT-2 저해제를 복용 중인 환자도 포함할 예정이다. 큐라클은 전체 임상 환자 중 약 50%를 SGLT-2 저해제 복용 환자 모집 계획이다.
이 외에도 습성 황반변성 치료제 CU03도 병용 임상 2b상을 앞두고 있다.



![더블유에스아이, ‘유봇’으로 의료로봇 도전장[인베스트 바이오]](https://image.edaily.co.kr/images/vision/files/NP/S/2025/07/PS25071300096b.jpg)


![[르포] 안드로이드 탄생한 보스턴CIC가보니…"K-바이오, 빅딜 마중물"](https://image.edaily.co.kr/images/vision/files/NP/S/2025/07/PS25071401146b.jpg)
![유한양행 ‘렉라자’ 글로벌 매출 급증에 20% ↑…제넥신·국전약품 上[바이오 맥짚기]](https://image.edaily.co.kr/images/vision/files/NP/S/2025/07/PS25071800211b.jpg)
![美FDA, 신약 허가 거절시 보완요구서한 공개[제약·바이오 해외토픽]](https://image.edaily.co.kr/images/vision/files/NP/S/2025/07/PS25071900105b.jpg)

