팜이데일리 프리미엄 기사를 무단 전재·유포하는 행위는 불법이며 형사 처벌 대상입니다.
이에 대해 팜이데일리는 무관용 원칙을 적용해 강력히 대응합니다.
[이데일리 김지완 기자]
지노믹트리(228760)가 독보적인 방광암 진단 기술력을 앞세워 미국 시장 진출 초읽기에 들어갔다.
 | | 지노믹트리 홈페이지. (갈무리=김지완 기자) |
|
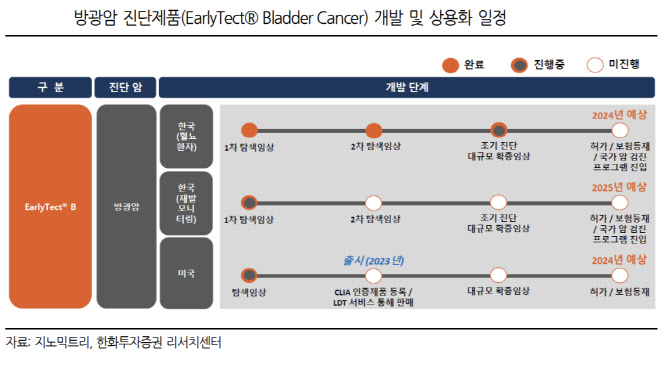
6일 지노믹트리에 따르면 방광암 진단키트 ‘얼리텍B’가 내년 1분기 미국 전역에서 진단서비스를 개시할 계획이다. 얼리텍B는 현재 미국에서 200명의 환자를 대상으로 탐색임상을 진행하고 있다. 이 임상은 지난해 12월부터 미국 UCLA 메디컬센터 병리과·비뇨기과에서 실시 중이고, 올해 11월 마무리될 예정이다. 국내에선 지난해 6월 1차 567명, 2차 183명 등을 대상으로 두 차례 탐색 임상시험을 완료하고 확증 임상을 진행하고 있다.
내년 1분기 미국에서 조기 상용화 지노믹트리 관계자는 “얼리텍B는 LDT(Laboratory Developed Test) 제도를 이용해 내년 1분기부터 미국 전역에서 방광암 검사 서비스를 실시할 계획”이라면서 “코로나19 진단키트 역시 LDT 제도를 이용해 미국 식품의약국(FDA) 품목허가 전 미국 내 진단서비스를 했다”고 설명했다.
지노믹트리는 지난 2019년 미국 캘리포니아에 자회사 ‘프로미스’(Promis)를 설립했다. 이 회사는 이를 바탕으로 지난 2020년 6월 미국실험실 표준인증(CLIA) 자격을 획득했다. 미국 LDT 제도는 ‘클리아랩’(CLIA Lab) 인증을 받은 곳에 한해, FDA 승인 전에도 미국 전역에서 자체 개발 진단·검사 서비스를 할 수 있도록 허용한다.
지노믹트리 관계자는 “진단키트 서비스는 시장 선점이 중요하기 때문에 빠른 상용화가 중요하다”면서 “아울러 LDT 제도를 통한 시판은 임상데이터 축적이 용이해 시장 침투력을 높일 수 있다”고 말했다.
얼리텍B는 내년 미국 확증임상 후 오는 2024년 FDA 정식 품목허가 신청서를 낼 계획이다. 국내에선 올해 1월부터 서울대병원을 비롯 9개 기관에서 3453명을 대상으로 확증 임상시험을 진행하고 있다. 국내 확증임상은 올해 11월 마무리 될 예정이다. 얼리텍B는 내년 식품의약품안전처(식약처) 품목허가 신청 및 2024년 보험등재 추진 등으로 국내 상업화에 나설 계획이다.
소변 방광암 진단키트에선 경쟁자 없어 얼리텍B는 기술 우위를 바탕으로 미국 방광암 진단시장에 침투할 수 있다고 판단했다. 지노믹트리 관계자는 “현재 방광암 진단은 혈노환자 대상으로 요도에 내시경을 넣는 방광경 검사가 표준진단검사”라면서 “하지만 이 검사 방식은 극심한 통증을 유발하고, 세균 감염 위험도 높다”고 설명했다.
이런 상황에서 미국 ‘퍼시픽 엣지’(Pacific Edge)는 소변으로 방광암을 진단할 수 있는 검사키트(CxBladder)를 내놓으며 시장 판도를 바꾸고 있다. 실제 퍼시픽 엣지의 방광암 진단키트는 검사 편의성을 앞세워 출시 2년 만에 매출 1140만달러(148억원)를 기록했다.
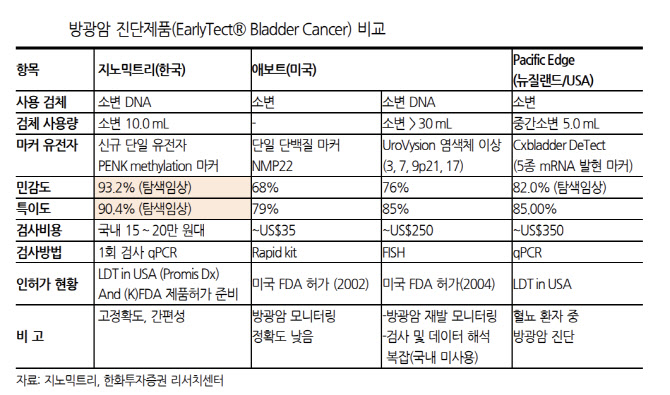
문제는 이 퍼시픽 엣지의 방광암 진단키트는 민감도 82.0%, 특이도 85.0%를 나타내며 검사 정확도가 크게 떨어진다는 데 있다. 반면 지노믹트리의 얼리텍B는 동일한 소변 검사 방식이면서도 민감도 93.2%, 특이도 90.4%로 비교우위를 나타낸다.
검사 비용에서도 얼리텍B가 경쟁력이 있다. 퍼시픽 엣지 방광암 진단키트의 검사 비용은 평균 350달러(45만원) 내외다. 반면, 얼리텍B는 15만~20만원 수준이다. 퍼시픽 엣지의 방광암 진단키트는 지난 2020년 LDT 제도를 통해 미국에서 검사 서비스를 개시했고, 아직 FDA 품목허가를 받지 못한 상태다.
“美 시장 출시하자마자 성과 기대” 얼리텍B에 대한 시장 기대치는 상당히 높다. 황세환 FS리서치 연구원은 “방광암 시장을 좋게 보는 이유는 경쟁자가 많지 않다는 데 있다”면서 “(얼리텍B)는 출시만 하면 확실한 매출이 발생할 가능성이 높다”고 내다봤다.
방광암은 미국에서 5번째로 흔한 암이다. 미국에서 방광암은 지난 2020년 8만 1400명이 신규 진단을 받았고 같은해 1만 7900명이 사망했다. 특히 방광암은 백인에게서 빈번하게 발생한다.
단기적으론 지노믹트리가 퍼시픽 엣지의 매출을 상당부분 잠식할 것이란 전망이다. 황 연구원은 “퍼시픽 엣지는 지노믹트리보다 민감도와 특이도가 떨어지는데도 미국 시장에서 출시하자마자 성과를 냈다”면서 “지노믹트리도 기대해 볼 만하다”고 판단했다.
장기적으론 방광암 진단검사 패러다임 변화 속에 지노믹트리가 최대 수혜자가 될 수 있을 것이란 전망이다. 황 연구원은 “지노믹트리의 소변 검사 방광암 진단키트는 현재로선 잠재적 경쟁자도 없는 상태”라고 강조했다.
미국 방광암 진단검사 시장 규모는 연간 최소 40만명에서 최대 160만명으로 추산된다. 방광암의 가장 전형적인 증상인 혈뇨 증세를 보이는 환자 가운데 방광암 환자는 5~20% 정도이기 때문이다. 1회 방광암 검사비용을 보수적으로 대략 15만원으로 잡아도, 미국 방광암 진단시장 규모는 600억원에서 최대 2400억원으로 추산된다.
방광암 진단키트의 국내 시장 매출 전망도 밝다. 지노믹트리 관계자는 “연간 국내 혈뇨 환자는 23만명이고 방광암 환자의 재발방지 검사 수요는 15만회로 추정된다”면서 “진단키트 공급가 15만원을 기준으로 연간 400억원의 매출이 발생할 수 있다”고 내다봤다. 지노믹트리는 지난해 매출 51억원, 영업손실 99억원을 기록했다.






!['2% 로열티'가 무너뜨린 신뢰…알테오젠發 바이오株 동반 하락[바이오맥짚기]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/01/PS26012201091b.jpg)


