팜이데일리 프리미엄 기사를 무단 전재·유포하는 행위는 불법이며 형사 처벌 대상입니다.
이에 대해 팜이데일리는 무관용 원칙을 적용해 강력히 대응합니다.
[시카고=이데일리 김지완 기자] ‘100%’.
앱클론(174900)의 CAR-T 치료제 AT101가 임상 1상에서 중·고용량 투약군에서 기록한 객관적반응률(ORR)이다.
 | | 윤덕현 서울아산병원 CAR-T센터장(교수)이 5일 일(현지시간) 미국 시카고에서 열린 미국임상종양학회(ASCO)에서 앱클론의 CAR-T 치료제 ‘AT101’의 임상 1상 최종 결과를 발표 중이다. (사진=김지완 기자) |
|
윤덕현 서울아산병원 CAR-T센터장(교수)은 5일(현지시간) 미국 시카고에서 열린 미국임상종양학회(ASCO)에서 앱클론의 CAR-T 치료제 ‘AT101’의 임상 1상 최종 결과를 발표했다.
이날 이데일리는 미국 시카고에서 열린 ASCO 포스터 발표 현장을 찾아 AT101의 임상을 총괄했던 윤 교수를 인터뷰했다.
“AT101 ORR 100%,,.킴리아도 50%에 불과” 윤 교수는 “킴라아가 임상 2상 후 객관적반응률이 50% 수준”이라면서 “이에 비해 AT101은 중·고용량에선 100%, 저용량까지 합산해도 91.7%로 우수한 효능을 나타냈다”고 비교했다.
앱클론은 총 12명의 혈액암 환자들을 대상으로 AT101 임상 1상을 진행했다. AT101 임상 1상은 저용량군 6명에게 T세포를 몸무게 ㎏당 20만개를 주입했다. 3명의 중용량 투여군은 100만개, 3명의 고용량 투여군엔 500만개 순으로 투입량을 늘렸다.
이 임상에서 암세포가 말끔하게 완전히 완전관해(CR) 환자만 8명이다. 완전관해 비율은 66.7%에 달한다. 나머지 4명 중 2명은 부분관해(PR)다. 부분관해는 암세포가 치료 전보다 30% 이상 줄어든 것을 말한다.
그는 “고용량을 투약한 부분관해 환자 1명은 완전관해로 전환되기 직전”이라며 “사실상 중·고용량 투여군에선 완전관해가 100% 나올 가능성이 높다”고 내다봤다. 임상 1상은 안전성 테스트를 위해 순차적으로 투약 용량(dose escalation)을 늘린다. 그 결과, 저용량에 비해 상대적으로 고용량 투여군은 관찰 시간이 짧았다.
“1상 결과 예상대로...기존 치료제보다 뛰어나” 윤 교수는 “AT101은 상업화된 CAR-T 치료제보다 암세포 결합부위가 가깝고 인간화 항체를 사용하기에 약 효능이 좋을 것으로 기대했다”면서 “이러한 기대가 임상 1상 결과로 나온 것”이라고 말했다,
킴리아, 예스카다, 테카투스, 브레얀지 등 상용화된 CAR-T 치료제는 모두 CD19 항원을 표적으로 삼고 있다. 문제는 이들 치료제는 모두 같은 항체 결합부위를 사용한다. 반면 AT101은 기존 CAR-T 치료제와 CD19 결합(에피토프) 위치가 다르다. 구체적으로 AT101은 기존 CAR-T 치료제보다 암 세포 가까이 결합하면서 치료 효능이 높게 나온다. 아울러 킴리아는 예스카다, 테카투스, 브레얀지 등과 동일한 치료제다. 즉, 킴리아 불응환자에게 여타 다른 치료제를 투약할 수 없지만 AT101은 투약이 가능하다는 얘기다.
지금까지 승인된 글로벌 CD19 표적 CAR-T 치료제는 모두 마우스 유래 FMC63 항체를 사용하고 있다. 앱클론은 세계 최초로 h1218 인간화 항체를 사용한다.
종전의 CAR-T 치료제는 생쥐 유래 단백질을 이용했다. 생쥐 유래 단백질은 투약 후 면역반응이 유발돼 약효 지속성이 떨어진다. 인체가 생쥐 유래 단백질을 외부 침입자로 판단해 치료제를 공격하기 때문이다. 반면, 앱클론은 인간화 항체를 개발해 면역반응 유발을 최소화했다. 인체가 AT101을 외부 침입자로 인식하지 않는다. 치료제 체내 잔류 시간 증가로 약 효능이 올라갈 수밖에 없다.
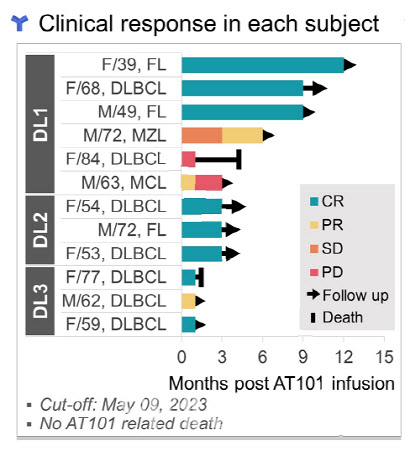 | | AT101 임상 1상 전체 데이터(지난달 9일 기준). 초록색은 완전관해, 노란색은 부분관해다. (자료=앱클론) |
|
“고용량 투여하는 2상 결과 기대” AT101의 투약 예후도 무척 좋다. 초기에 투약한 저용량 투여군 가운데 1명은 12개월 이상 완전관해를 유지 중이다. 또 다른 2명의 저용량 투여 환자도 9개월 이상 완전관해를 이어가고 있다. 환자 1명은 6개월간 안정병변을 거쳐 부분관해가 나타나는 등 상태가 호전되고 있다.
윤 교수는 “이분들 모두 아산병원 환자들로 내가 돌보고 있다”며 “투약 1년이 지났는 데도 불구하고 재발없이 아주 잘 지내고 있다”고 말했다.
AT101은 안전성에도 합격점을 받았다. 그는 “임상 1상에서 가장 주된 점은 안전성”이라며 “AT101은 예상치 못한 부작용이 없었다. 전체적으로 굉장히 양호한 안전성 값을 보여줬다”고 말했다.
윤 교수는 “오늘 새벽 AT101 임상 2상 투약용량을 몸무게 ㎏당 500만개의 T세포를 주입하는 것으로 결론냈다”면서 “중·고용량 투약환자 100%에서 반응이 나온 만큼 AT101 임상 2상을 기대해도 좋다”고 말했다.
한편, 앱클론은 AT101의 이 같은 임상 성과로 보스턴에서 열리는 바이오USA에서 20건 이상의 기술수출 미팅을 진행할 예정이다.







!['2% 로열티'가 무너뜨린 신뢰…알테오젠發 바이오株 동반 하락[바이오맥짚기]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/01/PS26012201091b.jpg)


