[이데일리 송영두 기자] 글로벌 제약사 리제네론이 차세대 면역항암제로 개발 중인 피안리맙과 면역관문억제제 리브타요의 신장암 병용 임상에서 기대했던 효능을 입증하지 못했다. 해당 결과는 국내 바이오 업계에서도 이목을 끌었다. 임상 디자인이
신라젠(215600) 펙사벡과 리브타요의 병용 임상과 유사해서다. 특히 피안리맙-리브타요 병용 효능이 펙사벡-리브타요 병용 효능보다 뒤떨어지는 것이 확인된 만큼, 신라젠 펙사벡이 오히려 주목받는 계기가 될 것이란 분석이 나온다.
25일 제약바이오 업계에 따르면 미국 임상종양학회 비뇨생식기암 심포지엄(ASCO GU 2024)에서 면역관문억제제 리브타요와 개발 중인 차세대 면역항암제 LAG-3 피안리맙의 진행성 투명신세포암(ccRCC) 대상 병용 임상 1상 결과를 발표한다.
지난 23일 ASCO GU 2024 홈페이지를 통해 먼저 공개된 연구결과에 따르면 리브타요-피안리맙 병용 임상 1상 결과, 허용 범위의 안전성은 확인됐지만, 반응률 등 유효성은 입증하지 못했다. 두 그룹으로 나눠서 진행된 이번 연구에서 객관적 반응률 등 업계가 기대했던 수치는 나오지 않았다.
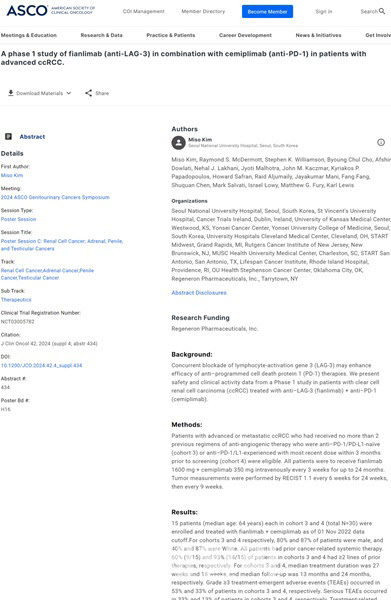 | | 미국 임상종양학회 비뇨생식기암 심포지엄(ASCO GU 2024)에서 공개된 리제네론 피안리맙-리브타요 신장암 병용 임상 1상 연구 결과.(자료=ASCO GU 홈페이지) |
|
객관적 반응률 20%·6.7%...기대치 못미쳐리제네론의 이번 임상 핵심은 독자적 기술로 개발한 리브타요와 글로벌 면역항암제 분야에서 신규 타깃으로 주목받고 있는 LAG-3 억제제 피안리맙의 효능이다. 피안리맙은 리제네론이 개발 중인 차세대 면역항암제다. 리브타요와 다양한 적응증을 대상으로 한 병용 임상 연구를 진행 중이다. LAG-3는 T세포에서 발현되는 단백질이다. T세포 활성화 및 사이토카인 분비를 억제한다. LAG-3을 차단해 T세포의 암세포 살상 기능을 회복시키고 사이토카인 분비를 줄여 항암 효과를 기대하고 있다.
하지만 환자 30명을 대상으로 한 임상 1상에서 기대치보다 낮은 반응률을 나타냈다. 피안리맙과 리브타요를 병용 치료하는 코호트3 그룹과 코호트4(면역관문억제제 치료 경험 환자군) 그룹에 각각 15명의 환자가 등록됐다. 임상 결과 코호트3 그룹의 객관적 반응률(ORR)은 20%(3명 부분반응), 코호트4 그룹은 6.7%(1명 부분 반응)를 기록했다.
안전성에서는 큰 문제가 발생하지 않았다. 3등급 이상의 치료 관련 이상반응(TEAE)은 코호트3 그룹과 코호트4 그룹 환자에서 각각 53%, 33% 발생했다. 코호트3 그룹에서는 3명의 환자, 코호트4 그룹에서는 1명의 환자에서 이상 반응으로 인해 치료가 중단됐다. 코호트 3그룹에서는 사망자 1명 발생했다. 이외의 이상 반응은 발진, 피로 등 모두 통제 범위 안에 있는 부작용이었다.
다만 이번 연구의 객관적 반응률은 앞서 진행된 신라젠의 펙사벡과 리브타요 병용 임상 2상 결과와 비교해보면 기대에 못 미친다는게 업계 관계자들의 중론이다. 실제로 지난해 11월 신라젠이 발표한 신장암 대상 펙사벡-리브타요 병용 임상 2상 결과 피안리맙-리브타요 병용 임상에서는 나오지 않았던 완전 관해(CR)도 1명 나왔고, 객관적 반응률도 훨씬 높았다.
임상 디자인 유사, 객관적 반응률서 펙사벡 판정승 평가펙사벡-리브타요 병용 임상 2상에서는 두 약물을 병용 투여한 C군(30명)과 D군(28명)의 객관적 반응률은 각각 23.3%, 17.9%로 나타났다. D군의 경우 면역관문억제제 치료 경험이 있는 환자(PD-1/L1)로 구성됐다. 이를 피안리맙-리브타요요 병용 임상 환자군과 대조해보면 C군의 객관적 반응률은 코호트3 그룹의 객관적 반응률보다 3.3% 높고, D군은 코호트4 그룹보다 무려 11.2% 높았다. 문제는 같은 신장암 대상 임상이라도 결과를 직접적으로 비교 가능하냐는 것인데, 업계에서는 충분히 가능하다는 설명이다.
항암제 개발 기업 한 관계자는 “이번에 리제네론이 진행한 피안리맙 병용 임상과 신라젠 펙사벡-리브타요요 병용 임상은 디자인이 매우 흡사하다”며 “두 약물을 정맥으로 병용 투여하고, 일부 군은 면역관문억제제 치료 경험이 있는 환자로 구성됐다는 점에서 적응증은 미세하게 다르지만, 직간접적인 비교가 가능하다”고 말했다.
리제네론이 개발한 리브타요는 PD-1 계열 치료제 중 가장 후발주자에 속해, 기존 치료제들이 공략하지 못한 시장을 타깃하고 있다. 따라서 이번 피안리맙 병용 임상 결과는 리제네론은 물론 리제네론과 펙사벡 임상을 공동 진행 중인 신라젠에도 상당한 의미가 있다는 분석이다.
업계 관계자는 “리제네론 입장에서는 리브타요가 후발 주자인 만큼 코호트4 그룹과 펙사벡 병용 임상 D군의 결과가 매우 중요할 것으로 보인다”며 “피안리맙 병용 임상이 아직 1상이라는 점에서 향후 개발 과정을 더 지켜봐야겠지만, 현재로서는 펙사벡 병용 대비 효과가 떨어지는 것은 부인할 수 없다”고 설명했다.
이어 “LAG-3 계열 약물 역시 차세대 면역항암제로 주목받고 있는 만큼 계속 개발이 이어질 것”이라면서 “다만 PD-1과의 조합은 신장암 분야에서는 LAG-3보다 펙사벡과 같은 항암바이러스가 좀 더 시너지가 있다는 일정의 판정승을 거둔 양상”이라고 평가했다. 특히 신라젠은 펙사벡-리브타요 병용 임상 2상 결과를 바탕으로 리제네론과 기술수출을 포함한 다양한 협력 방안에 대해 논의하고 있는 것으로 알려졌는데, 이번 연구결과가 해당 논의에도 상당한 영향을 끼칠 전망이다.





 (좌측상단)
(좌측상단) (우측상단)
(우측상단) (우측상단)
(우측상단)





![[참 고소한 이야기]치매 예방에 탁월한 들기름](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042000024b.jpg)
![[아미코젠 대해부①] 바이오 원료 국산화 선봉장 신용철 아미코젠 의장](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/03/PS24032000190b.jpg)
![[임상 업데이트] GC녹십자, 산필리포증후군 치료제 美 FDA 임상 신청](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/04/PS24042700171b.jpg)

