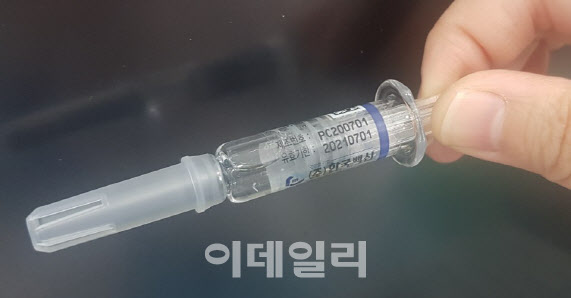
 | | 침전물 발견 독감 백신 (사진=식약처) |
|
[이데일리 노희준 기자] 한 주(10월5일~10월9일) 제약·바이오업계에서 주목받은 뉴스다
△ 또 독감 백신 사고, ‘백색 침전물’ 발견…61.5만개 회수
‘상온 노출’ 독감 백신 사고에 이어 독감 백신 일부에서 침전물이 발견돼 제약사가 61만 5000개의 물량을 자진 회수하는 일이 발생했다. 오는 13일 재개될 예정인 국가예방접종사업에 차질이 우려된다. 식약처는 9일 긴급 기자회견을 통해 한국백신의 인플루엔자 백신 ‘코박스플루4가PF주’의 4개 제조단위 총 61만 5000개에 대해 제조사가 자진 회수한다고 밝혔다. 식약처는 지난 6일 경상북도 영덕군 보건소에서 해당 제품 안에서 백색 입자가 발견됐다는 보고를 받고 긴급 수거·검사 등에 나서 백색입자를 확인했다. 전문가 자문 결과, 백색 입자는 항원단백질 응집체로 보이며 주사부위 통증·염증 등 국소작용 외에 안전성 우려는 낮다고 식약처는 전했다.
해당 백신은 콜트 체인(정온 배송)에는 문제가 없었다. 식약처는 유통과정보다는 제조과정에서 백신 원액을 주사기에 주입하는 과정에서 발생한 문제로 보고있다. 9일 오후 3시 기준 코박스플루4가PF주 접종자수는 1만7812명으로 파악됐다. 현재까지 보고된 이상사례는 1건(국소통증)이다. 앞서 정부는 신성약품의 독감 백신 운송 과정에서 상온에 노출된 것으로 의심되는 국가예방접종 사업 백신 48만명분을 수거했다. 이번 자진 회수 물량은 61만5000개다. 두 차례에 걸쳐 백신 회수 결정이 내려지면서 향후독감 백신 접종에 차질을 빚을 우려가 나온다. 식약처는 이번 자진회수 물량에는 ‘상온노출’로 회수되는 48만명분과 중복된 게 있다며 현재 수량을 확인 중이라고 설명했다.
△정부 “상온노출 독감백신, 안전성 문제 없다...48만도즈 수거”
유통 과정에서 상온에 노출된 것으로 의심돼 사용이 중지된 인플루엔자(독감)백신이 정부 조사 결과 안전성에는 문제가 없는 것으로 나타났다. 백신 효력에 영향을 줄 우려가 있는 일부 백신(48만 도즈=1회 접종분)은 수거된다. 식약처는 6일 질병관리청과 함께 이런 ‘상온 노출’ 독감 백신에 대한 유통 조사 및 샘플 품질 조사 결과를 밝혔다. 정부는 “전체 유통조사 결과, 인플루엔자 백신은 25℃에서 24시간 노출범위 내에서 배송됐다”며 “유통 과정 중 기준온도(2~8℃)를 초과한 일부 백신을 수거해 품질검사를 시행해 모두 적합 판정을 받았다”고 설명했다. 정부는 다만 0℃미만 온도에 일부 시간 노출된 물량(27만 도즈), 호남 일부 지역에서 백신 상·하차 작업이 야외에서 이뤄져 백신이 바닥에 일시 적재됐던 물량(17만 도즈), 적정 온도(2~8℃) 이탈시간이 비정상적으로 길게 배송된 물량(800분, 2000도즈), 개별 운송돼 운송 과정에 온도 확인이 되지 않은 물량(3만 도즈) 등 총 48만 도즈는 수거할 예정이다.
△엘러간 인공유방 국내 세번째 희귀암 발생
지난해 문제가 불거진 미국 엘러간의 거친 표면 인공유방 보형물을 이식받고 희귀암이 생긴 환자가 추가로 발생했다. 국내 세번째 환자다. 5일 정춘숙 더불어민주당 국회의원이 식약처에서 제출받아 발표한 자료에 따르면, 유방 보형물 관련 역형성 대세포 림프종(BIA-ALCL)국내 세 번째 환자가 6월 20일 진단받고 7월 7일에 보고됐다. 앞서 미국 엘러간은 거친 표면 인공유방과 연관된 역형성 대세포 림프종 발생을 이유로 지난해 7월 25일 제품 자진 회수를 발표하고 회수 지시 및 사용중단을 알렸다. 국내에서는 지난해 8월 16일 첫 번째 환자가, 같은해 12월 24일에 두 번째 환자가 보고됐다. BIA-ALCL은 면역체계와 관련된 암의 한 종류로 유방암과는 별개 질환이다. 의심 증상으로는 장액종으로 인한 유방 크기 변화, 피막에 발생한 덩어리나 피부 발진 등이 있다.
△올릭스, 프랑스 안과 전문기업에 최대 9000억대 규모 기술수출
리보핵산(RNA) 치료제 개발 국내 기업
올릭스(226950)가 최대 4개의 안과질환 치료제 후보물질을 프랑스 안과 전문기업 떼아 오픈 이노베이션(Thea Open Innovation)에 최대 약 6억7000 유로(9160억원) 규모로 기술이전하는 계약을 체결했다고 7일 밝혔다. 우선 전임상 단계에 있는 건성·습성 황반변성 치료제 후보물질인 ‘OLX301A’와 망막하 섬유화증 및 습성 황반변성 치료제 후보물질인 ‘OX301D’를 수출한다. 한 후보물질당 선급금과 단계별 마일스톤을 합쳐 1억6695만 유로(2282억 원)를 받는다. 이와 별개로 올릭스는 2년 안에 떼아 오픈 이노베이션에 새 안질환 치료 후보물질 두 개를 추가로 기술이전 할 수 있다. 이 계약까지 이뤄지면 1060만 유로(144억원)의 선급금을 포함해 최대 4564억원 규모의 기술이전이 추가로 발생한다.
△메디톡스, ‘메디톡신’ 국내 최초 우크라이나 시판허가 획득
메디톡스(086900)의 보톡스 제품 ‘메디톡신’이 국내 최초로 우크라이나 시장에 진출하게 됐다. 메디톡스는 보툴리눔 톡신 제제(보톡스) ‘메디톡신’(수출명 뉴로녹스)이 국내 최초로 독립국가연합(CIS) 지역의 주요 국가 중 하나인 우크라이나 시판허가를 획득했다고 8일 밝혔다. 현재 우크라이나에 정식 등록된 보툴리눔 톡신 제제는 미국 엘러간의 보톡스(Botox), 프랑스 입센의 디스포트(Dysport), 독일 멀츠의 제오민(Xeomin) 등 3개뿐이다. 우크라이나는 인구 약 4400만명의 동유럽 국가로 CIS 지역 내 K-뷰티 중심지로 손꼽힌다. 메디톡스는 우크라이나 현지 업체 ‘이멧(EMET)’과 파트너 계약을 체결해 현지에 메디톡신을 공급한다.
△셀트리온, 천식 치료제 바이오시밀러 임상 3상 계획 승인
셀트리온(068270)이 알레르기성 천식 및 만성 두드러기 치료제인 ‘졸레어’ 바이오시밀러의 글로벌 임상 3상을 본격화한다. 셀트리온은 7일 식약처에서 졸레어(Xolair, 성분명 오말리주맙)의 바이오시밀러 ‘CT-P39’의 임상시험계획(IND)을 승인받았다고 8일 밝혔다. 이에 따라 회사측은 특발성 두드러기 환자 600명을 대상으로 국내를 비롯해 전 세계 7개국 약 65개 임상시험기관을 통해 임상 3상을 진행할 예정이다. 셀트리온은 CT-P39와 졸레어의 비교 임상시험을 통해 유효성 및 안전성 측면에서 동등성을 입증하고, 2023년 상반기 내 임상 3상을 마친다는 목표다. 졸레어는 제넨테크(Genentech)와 노바티스(Novartis)가 판매하는 항체 바이오의약품으로 지난해 글로벌 매출 약 3조9000억원을 기록한 블록버스터 제품이다.
△파미셀, 생산규모 2배 확대 설비 증설 결정
파미셀(005690)이 글로벌 수요 증가에 대응하기 위해 울산공장 원료의약품(뉴클레오시드, mPEG)생산규모를 2배로 확대하는 생산설비 증설에 나선다고 6일 밝혔다. 증설이 완료되면 파미셀의 원료의약품 연간 생산규모는 16톤 규모로 늘어난다. 회사측은 공장 증설 완공 시점을 내년 하반기로 잡았다. 총 106억원의 증설비용 대부분은 자기자금으로 투입할 방침이다. 파미셀이 생산하는 원료의약품 ‘뉴클레오시드’는 코로나19 치료제인 미국 길리어드사언스의 항바이러스제 렘데시비르의 주원료다. 또 파미셀이 공급하는 mPEG는 다국적제약사 UCB의 자가면역질환 치료제 대표 제품 ‘심지아’를 생산하는 데 쓴다. 파미셀 관계자는 “공장 증설에 따라 연간 원료의약품 매출액도 현재 184억 수준에서 3배 이상 상승할 것”이라고 기대했다.
△테라젠바이오, ‘코로나19 조기진단’ 국책과제 주관기관 선정
유전체 분석기업
테라젠이텍스(066700)의 바이오 부문을 분할해 설립한 테라젠바이오는 코로나19 방역 기술 개발을 위해 정부가 추진하는 첫번째 국책과제인 ‘코로나19 조기 진단 기술 고도화’ 연구의 주관기관으로 선정됐다고 5일 밝혔다. 이에 따라 테라젠바이오는 앞으로 2년 6개월간 국고를 지원받아 코로나19 등 감염병의 대규모 전수조사를 위한 진단법을 개발하게 된다. 연구가 완료되면 각급 학교 개학 전 전수조사, 확진자(의심자) 발생 시설 및 기관, 기업, 지역 전수조사, 의료 종사자를 대상으로 한 주기적 검사 등 대규모 진단에 활용된다.
△녹십자홀딩스, 북미 혈액제제 계열사 매각대금 5500억원 수령
녹십자홀딩스(005250)는 지난 1일 스페인 그리폴스(Grifols)에서 북미 법인(GCBT·GCAM) 주식매각대금을 수취했다고 5일 밝혔다. 앞서 녹십자홀딩스는 지난 7월 그리폴스에 캐나다에 있는 혈액제제 생산공장과 미국 혈액원 사업부문을 4억6000만달러(5520억원)에 매각했다. 녹십자홀딩스는 지난 2017년 GCBT를 설립했지만 의약품 제조관리기준(GMP) 인증절차가 늦어지면서 공장을 제대로 가동하지 못했다. 이에 따라 양사가 주식매매계약을 체결한 지 석달여 만에 기업가치 기준으로 4억6000만달러에 달하는 양수도 작업이 마무리됐다. 녹십자홀딩스는 이번 매각에 따른 자금유입을 통해 재무건전성을 확보하고 사업정리를 통해 북미 혈액제제 부문은 GC녹십자로 집중할 계획이다.
△‘손떨림 극복’ 국산로봇이 척추 수술하는 시대 열렸다
국내 기술로 개발한 척추수술로봇이 처음으로 국내 병원에서 실제 척추질환 환자 수술에 사용됐다. 사람 손 떨림과 눈의 한계를 극복한 차세대 의료로봇 시대가 한걸음 더 다가왔다는 평가다. 의료 로봇 전문기업
큐렉소(060280)는 자체 기술로 개발한 척추수술로봇 ‘큐비스-스파인(CUVIS-spine)’을 활용한 수술이 세브란스병원에서 성공적으로 시행됐다고 6일 밝혔다. 큐비스 스파인은 척추질환 환자의 척추를 안정적으로 고정하기 위해 척추뼈에 나사못을 삽입하는 척추경 나사못 고정술을 할 때 수술계획에 따라 수술 도구의 위치를 잡아주는 의료기기다. 세브란스병원은 큐비스 스파인을 활용해 척추관 협착증 등의 척추질환이 있는 환자에게 척추경 나사못 고정술을 시행했다. 환자는 증상이 호전돼 수술 후 5일째 정상적으로 퇴원했다.
△제넥신 지속형 성장호르몬, 中 임상3상 승인
제넥신(095700)은 파트너사인 아이맵이 중국 약물평가센터(CDE)에서 기존 제품대비 투여 횟수를 줄인 지속형 성장호르몬 제제(GX-H9)의 중국내 임상 3상 시험을 승인받았다고 5일 밝혔다. 아이맵은 올해 1월 나스닥에 상장한 글로벌 바이오 신약개발기업이다. 제넥신에서 지속형 성장호르몬인 GX-H9을 포함한 3개 파이프라인을 기술이전해 중국 출시를 목표로 하고 있다. 이에 따라 아이맵은 이번 임상 3상에서 중국내 224명의 성장호르몬 결핍 소아환자를 대상으로 다기관에서 주1회 투여 후 안전성과 효능을 확인할 예정이다. GX-H9은 제넥신의 지속형 플랫폼기술(hyFcTM)를 기반으로 만든 성장호르몬(rhGH) 제제다.
△한올바이오, 자가면역질환 치료제 中 임상 2상 투여
한올바이오파마(009420)는 중국 파트너인 하버바이오메드(Harbour BioMed)가 중증근무력증과 혈소판감소증에 대한 자가면역질환 치료제 후보물질 HL161의 임상 2상 시험 환자 투약을 시작했다고 5일 밝혔다. 한올바이오파마는 2017년에 HL161에 대한 북미, 중남미, 유럽, 중동, 북아프리카 지역 사업권을 스위스 로이반트(현 이뮤노반트)에, 중국지역(홍콩, 대만, 마카오 포함)에 대한 사업권을 중국 하버바이오메드에 이전했다. HL161은 우리 몸의 대표적 항체인 IgG 항체의 반감기를 늘려주는 FcRn 억제제다. 이를 통해 병원성 자가항체의 체내 분해를 촉진해 자가면역질환을 치료하는 새로운 작용기전의 항체신약 후보물질이다.
△GC녹십자엠에스, 220억 규모 유럽 수출 계약 체결
진단시약 및 의료기기 전문기업 GC
녹십자엠에스(142280)가 1900만 달러(220억원) 규모의 유럽 수출 계약을 체결했다. GC녹십자엠에스는 폴란드 기업인 핸드프로드(Handprod)와 1100만 달러 규모의 혈당측정기 및 당화혈색소 측정시스템 공급계약을 체결했다고 6일 밝혔다. 이 회사는 또 스위스 기업인 메디시스(Medysis)와 800만 달러 규모의 코로나19 및 인플루엔자 콤보진단키트, 코로나19 형광면역 항원진단키트의 공급계약을 체결했다. 두 계약을 합친 이번 총 수출 계약 규모는 1900만달러다. 이번 계약을 통한 제품 대부분은 유럽시장에 공급한다.
△식약처, 대웅제약 ‘구충제’ 코로나 치료제 임상 1상 승인
식약처는
대웅제약(069620)이 개발중인 코로나19 치료제 ‘DWRX2003’에 대해 1상 임상시험을 8일 승인했다고 이날 밝혔다. 이로써 현재 국내에서 코로나19 관련해 임상시험이 진행 중인 치료제 및 백신은 총 20건(치료제 18건, 백신 2건)이 됐다. 임상시험약인 ‘DWRX2003’는 현재 구충제로 사용되고 있는 성분(니클로사미드)이다. 경구투여 시 체내 흡수율이 낮다는 단점이 있어 대웅제약에서는 체내 흡수율을 높이기 위해 근육주사제로 개발했다고 식약처는 설명했다.
△셀리드, LG화학과 코로나19 백신 개발 상호협력 협약
항암면역치료백신 개발 전문기업
셀리드(299660)는 자체 개발하고 있는 코로나19 백신 ‘AdCLD-Cov19’의 개발 및 대량생산 협력체계 구축을 위한 협약을
LG화학(051910)과 체결했다고 5일 밝혔다. 셀리드는 지난 4월 ‘AdCLD-Cov19’백신의 개발을 개시한 이후 연구용 AdCLD-Cov19 백신 후보물질을 제작했다. 또 영장류 시험 결과 괄목할 만한 수준의 항원특이적 항체반응과 생성된 항체의 매우 높은 수준의 바이러스 중화능력도 확인했다.





![[르포] 안드로이드 탄생한 보스턴CIC가보니…"K-바이오, 빅딜 마중물"](https://image.edaily.co.kr/images/vision/files/NP/S/2025/07/PS25071401146b.jpg)
![이승호 데일리파트너스 대표 “하반기 바이오 전망 밝다, 다중항체 주목”[바이오 VC 집중조명]①](https://image.edaily.co.kr/images/vision/files/NP/S/2025/07/PS25071500005b.jpg)

