[이데일리 김진수 기자] 브릿지바이오가 사업의 지속적이고 원활한 운영을 위해 일부 파이프라인 개발을 중단하기로 결정했다. 브릿지바이오 입장에서는 최선의 선택이었겠지만 그동안 브릿지바이오의 파이프라인과 연구개발 과정을 지켜보던 투자자들의 믿음에는 금이 가게됐다.
브릿지바이오는 앞으로 주요 파이프라인 개발에 집중한다는 계획으로, 해당 물질의 기술수출에 성공해 투자자들과의 신뢰를 회복한다는 방침이다.
지난 26일 브릿지바이오는 공시를 통해 비소세포폐암 치료 후보물질 BBT-176과 안저질환치료제 후보물질 BBT-212 등 2개 후보물질의 개발을 포기했다고 밝혔다. 브릿지바이오 측은 이번 결정과 관련해 “연구 및 파이프라인 개발에 선택과 집중을 통해 자본효율성을 높이기 위한 전략적 선택”이라고 언급했다.
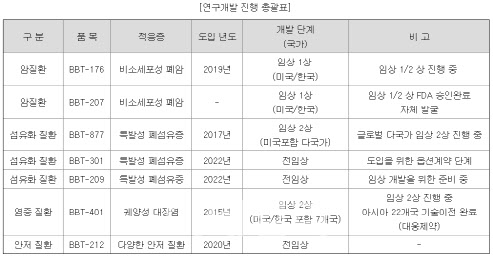 | | 2023년 상반기 기준 브릿지바이오의 파이프라인. (사진=전자공시시스템) |
|
대규모 자금 확보에도 임상 중단…투자자 신뢰도 하락 전망 브릿지바이오는 지난해부터 올해까지 두 차례 유상증자를 실시하면서 자금을 확보했다. 확보한 자금으로 파이프라인의 고도화에 힘쏟겠다고 밝혔던 만큼 이번 일부 파이프라인 개발 중단은 투자자들에게 다소 갑작스럽게 다가왔다는 분석이다.
지난해부터 올해까지 두 차례 유상증자를 하는 과정에서도 투자자들은 아쉬움을 삼킨 바 있다. 브릿지바이오는 지난 5월 신약 후보물질 임상 시험 등 연구·개발 등에 활용하기 위해 486억원 규모의 유상증자를 실시한 뒤, 올해 초까지 추가적인 자금 조달을 고려하지 않는다는 입장이었다.
그러나 올해 고금리 등 투자를 받기 어려운 상황이 지속되면서 지난달 60억원 규모의 유상증자를 또 한 차례 실시했다. 제3자 배정 등의 전략적 선택이었다고는 하지만 브릿지바이오를 믿고 있던 주주들에게는 아쉬움이 남는 대목이었다.
또 브릿지바이오가 지난해 5월과 올해 8월 실시한 유상증자를 통해 확보한 자금은 약 540억원 가량으로, 브릿지바이오가 올해 상반기 사용한 연구개발 비용 153억원과 비교하면 향후 약 2년 동안 연구개발에 활용할 수 있는 수준이다. 그럼에도 불구하고 브릿지바이오가 일부 파이프라인 개발을 정리하겠다고 밝히면서 주주들의 신뢰는 하락할 것으로 보인다.
특히, 브릿지바이오는 이번달 중순 ‘BBT-176의 임상 1상 후속 데이터에서 1일 2회 복용 시 비소세포폐암 세포가 부분적으로 사라지는 부분관해를 확인했다’며 대대적인 홍보를 실시한 바 있다. 브릿지바이오는 ‘신규 4세대 EGFR 저해제 개발 분야에서 글로벌 선두가 될 수 있도록 개발에 박차를 가할 것’이라고 언급하면서 투자자들의 기대를 높였던 만큼 파이프라인 정리에 대한 실망감도 더욱 클 전망이다. 브릿지바이오에 따르면 BBT-176 개발 과정에는 총 150억원 가량의 비용이 투입됐다.
브릿지바이오 관계자는 “이번 일부 파이프라인 개발 중단은 자금적으로 불가피한 선택이었다기 보다는 더 빠르게 성공 가능성이 있는 제품에 더 집중하기 위함”이라고 설명했다.
이밖에도 브릿지바이오는 지난해 7월 주주간담회에서 2023년 글로벌 임상 과제 5개 이상의 신약개발 파이프라인 구축을 목표로 하고 있으며 기술수출 성과를 내겠다고 밝혔다. 그러나 글로벌 임상 중인 파이프라인은 오히려 줄었고 기술수출 소식도 들리지 않는 상황이다.
어려운 상황에서도 기술수출 기대 이처럼 내외부적으로 어려운 상황이 지속되고 있지만 브릿지바이오는 주요 파이프라인에 대한 개발을 이어가고 있으며 이를 통한 기술수출을 계속 추진해 반전을 만든다는 계획이다.
브릿지바이오 관계자는 “BBT-877는 여전히 개발이 순항하며 글로벌 다국가 임상 2상 환자 30여 명 이상 투약 진행 중”이라며 “내년 글로벌 임상 2상 완료를 목표로 하고 있다”고 밝혔다.
또 비소세포폐암 치료제 후보물질 BBT-207는 미국 식품의약국(FDA) 및 한국 식약처로부터 임상시험계획(IND) 승인 이후 환자 등록 위한 스크리닝 단계에 돌입했다. 궤양성 대장염 치료제 후보물질 BBT-401는 임상 2a상 중·고용량군 5개국 다국가 임상 결과를 확보한 뒤 제형 개선 등 약물 개발 전략 고도화 진행할 방침이다.
끝으로 브릿지바이오 관계자는 “최근 비소세포폐암 치료제로는 3세대 EGFR 저해제가 대세로 자리 잡았지만 이후 삼중 돌연변이가 나타났을 때 쓸 수 있는 치료제에 대한 수요도 여전하다”라며 “BBT-176의 권리를 포기한 것은 아니기 때문에 일부 국가로 기술수출 가능성도 있다”고 말했다.





![인투셀, 특허이슈에 장외 하한가…퓨쳐켐, 진단제 국내 품목허가 추진[바이오 맥짚기]](https://image.edaily.co.kr/images/vision/files/NP/S/2025/07/PS25071000247b.jpg)
![[임상 업데이트] LG화학, 경구용 희귀비만 신약 2상서 체중 감소 효과](https://image.edaily.co.kr/images/vision/files/NP/S/2025/07/PS25071200105b.jpg)

