[이데일리 송영두 기자] 손상된 세포 및 조직, 장기 등을 대체하거나 원래 기능을 회복시키는 재생치료에 대한 투자가 급증하고 있다. 재생치료가 알츠하이머, 척추손상, 당뇨병 등 난치성 질환의 근본적 치료대안으로 부각되고 있기 때문이다.
한국바이오협회 ‘재생의료 산업 및 임상동향’ 리포트에 따르면 최근 재생의료 산업은 기존 세포, 조직 기반의 ‘재생의료’ 개념에서 혁신적 치료기술을 융합하는 ‘첨단재생의료’ 패러다임으로 전환되고 있다. 세포치료, 유전자치료, 조직공학치료 및 융복합 치료 등이 포함된다.
재생의료 관련 임상은 세계적으로 1171건의 임상이 진행 중이고, 이중 142건이 임상 3상 단계다. 미국 식품의약국(FDA)과 유럽의약품청(EMA)은 2025년까지 각 기관별 연간 10~20건의 세포 및 유전자치료제가 승인 받을 것으로 전망하고 있다. 재생의료 시장 규모는 2021년 147억 달러에서 2027년 504억 달러로 확대될 것으로 예상된다.
 | | (자료=한국바이오협회) |
|
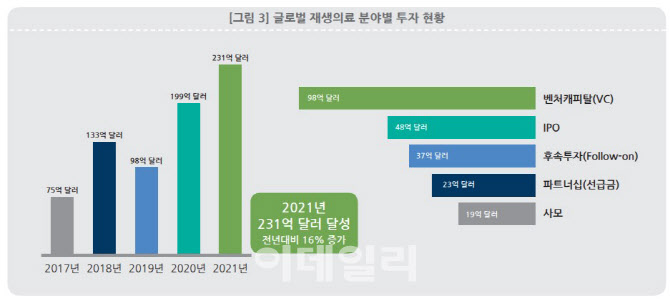
재생의료연합 보고서에 따르면 2021년 글로벌 재생의료 투자는 231억 달러로, 2020년 199억 달러 대비 16% 증가했다. 특히 민간 벤처투자(VC) 금액이 전년대비 73% 증가한 98억 달러를 기록해 가장 높은 수치를 기록했다. 그 뒤를 48억 달러의 IPO가 이었다.
특히 유전자치료제 기업들의 투자 증가 비율은 전체 투자의 1/3 비율로 증가했다. 2021년 기준 유전자 치료제 45%는 기업으로, 제약바이오 산업 구조가 합성의약품에서 바이오의약품으로 개편됨을 의미한다.
리포트에 따르면 재생의료 시장의 성장성이 높은 이유는 미국, 유럽 등 선진국 규제기관에서 신속허가 절차 지원 ‘패스트트랙’ 제도 활성화가 제품 파이프라인 개발을 뒷받침하고 있기 때문이다. 국내에서도 난치질환 환자들을 위해 첨단바이오의약품의 합리적 허가심사 체계를 마련함에 따라 신속허가 제도가 활성화 될 전망이다.
2021년 기준 미국, 유럽, 중국, 일본 등에서 6개의 재생의료 신약이 승인됐다. 그 중 ‘Abecma’, Breyanzi‘, ’Carteyva‘ 등 CAR-T 치료제가 3개 승인됐다. 올해 2월에도 중국 레전드 바이오텍과 얀센이 공동개발한 다발성 골수종 대상 CAR-T 치료제 ’CARVYKTI‘가 승인됐다.
글로벌 재생의료 시장이 확대되면서 국내에서도 유전자치료제, 세포치료제 등 첨단바이오의약품 개발이 활성화 되고 있다. 약 50% 이상 아웃소싱 위주의 첨단바이오의약품 산업 성장과 함께 관련 생산수요에 대응하기 위해 CDMO 시장에도 적극 뛰어들고 있다.
국내에서 허가받은 첨단바이오의약품은 총 18개 품목이다. 대부분 세포치료제인데,
지씨셀(144510)(GC셀),
메디포스트(078160) 등 15개 품목이 국내 기업들이 개발한 제품이다. 2020년 8월 첨단재생바이오법 시행에 따라 2021년 8우러 15개의 세포치료제 품목이 첨단바이오의약품으로서 재허가를 받았다. 지난해에는 3개의 유전자치료제가 허가를 받았는데, 모두 스위스 노바티스가 개발한 제품이다.
다만 김지운 한국바이오협회 바이오경제센터 연구원은 “첨단바이오의약품은 특성상 높은 단가로 가격 경쟁력에서 약점을 보인다. 또한 신약에 대한 인허가 절차 부분에서 분명한 어려움이 존재한다”고 말했다. 이어 “제도적 한계에도 불구하고 재생의료 및 첨단바이오의약품은 합성의약품을 대체하거나 미충족 의료를 해결할 수 있는 큰 기회가 될 것으로 전망한다. 임상연구, 안전성과 유효성, 급여등재까지 보장된다면 새로운 시장영역을 창출할 수 있는 산업으로 자리매김 할 것”이라고 말했다.






![[르포] 안드로이드 탄생한 보스턴CIC가보니…"K-바이오, 빅딜 마중물"](https://image.edaily.co.kr/images/vision/files/NP/S/2025/07/PS25071401146b.jpg)
![이승호 데일리파트너스 대표 “하반기 바이오 전망 밝다, 다중항체 주목”[바이오 VC 집중조명]①](https://image.edaily.co.kr/images/vision/files/NP/S/2025/07/PS25071500005b.jpg)

![[임상 업데이트] LG화학, 경구용 희귀비만 신약 2상서 체중 감소 효과](https://image.edaily.co.kr/images/vision/files/NP/S/2025/07/PS25071200105b.jpg)