팜이데일리 프리미엄 기사를 무단 전재·유포하는 행위는 불법이며 형사 처벌 대상입니다.
이에 대해 팜이데일리는 무관용 원칙을 적용해 강력히 대응합니다.
[이데일리 나은경 기자] 퇴행성 뇌 질환(CNS) 치료제 개발사인
카이노스메드(284620)는 올 1분기 주력 파이프라인 ‘KM-819’을 활용, CNS 질환 관련한 2개 임상 2상을 본격화한다. 앞서 임상 2상 주요 데이터를 확보한 뒤 기술이전에 나서겠다고 언급한 만큼 올해가 기술이전을 위한 분수령이 될 전망이다.
5일 카이노스메드에 따르면 KM-819는 이르면 1분기 중 두 가지 적응증을 타깃으로 임상 2상 첫 환자 투약을 개시할 예정이다. 2015년 한국화학연구원으로부터 카이노스메드가 라이선스인 한 KM-819는 현재 파킨슨병 치료제를 타깃으로 한 미국 임상 2상과 다계통위축증(MSA) 치료제를 타깃으로 한 국내 임상 2상을 동시 추진 중이다.
파킨슨병 근본치료제로 ‘혁신신약’ 노린다 카이노스메드가 개발 중인 KM-819는 현재 허가된 약이 증상완화제뿐인 글로벌 파킨슨병 시장에서 ‘혁신신약’(first-in-class) 지위를 노리고 있다. 파킨슨병은 독성이 있는 알파-시뉴클라인(aSyunclein) 단백질의 축적이 발병 원인 중 하나로 알려져 있다. 많은 글로벌 빅파마들이 알파-시뉴클라인을 직접 타깃하는 신약 연구에 몰두했지만 관련 임상들이 잇따라 실패한 바 있다. 반면 세포의 죽음을 촉진하는 단백질 FAF1을 타깃하는 KM-819는 FAF1 과발현을 억제해 도파민 신경세포의 사멸을 막고, 자가포식을 활성화시켜 알파-시뉴클라인 응집까지 억제한다는 점에서 주목을 받는다.
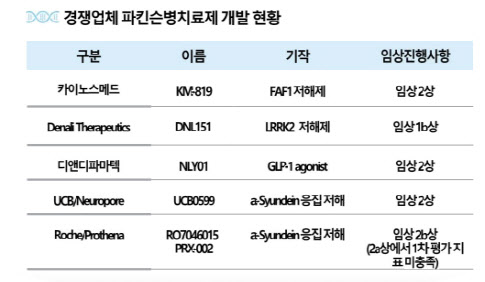
 | | 파킨슨병 치료제 개발 현황(자료=카이노스메드) |
|
KM-819는 지난달 건강한 환자 대상으로 한 약물 시험에서 안전성을 확인했다고 발표하면서 한때 상한가(전일 종가 대비 29.9% 상승)를 기록하기도 했다. 해당 시험은 임상 2상 파트1 중 A에 해당하는 것으로 1분기 중 파킨슨병 환자 24명을 대상으로 한 임상 2상 파트1 B를 개시할 예정이다.
회사 관계자는 “계획이 변수없이 진행될 경우 하반기 중에는 파트2 환자 투약 개시도 가능할 것”이라며 “알파-시뉴클라인을 직접 타깃하는 바이오젠과 GS(Glucosylceramide Synthase)를 타깃하는 사노피가 임상 2상을 자발적으로 중단하면서 KM-819처럼 신경세포보호와 알파-시뉴클라인에 동시 접근하는 방식이 업계에서 주목받고 있다”고 설명했다.
임상 2상 파트2는 파킨슨병 환자 288명을 대상으로 KM-819를 2년간 투여하는 것을 골자로 한다. 앞서 진행된 파킨슨병 임상 중 가장 큰 규모로 진행되므로 통계적 유의성을 확보하는 데 용이할 전망이다. 글로벌 시장조사업체 글로벌데이터(Global Data)에 따르면 주요 7개국(미국, 일본, 프랑스, 독일, 이탈리아, 스페인, 영국)의 파킨슨병 시장은 오는 2029년 115억달러(14조6000억원) 규모까지 성장할 것으로 추정된다.
“MSA치료제, 국내 임상 결과로 FDA 갈 것” MSA치료제의 임상 2상 환자 투약도 이르면 1분기 중 개시된다. 앞서 회사는 지난해 10월 환자 투약 개시를 목표로 했지만 주 연구자의 이직으로 임상 사이트가 변경되면서 투약 개시 시점이 다소 늦춰졌다.
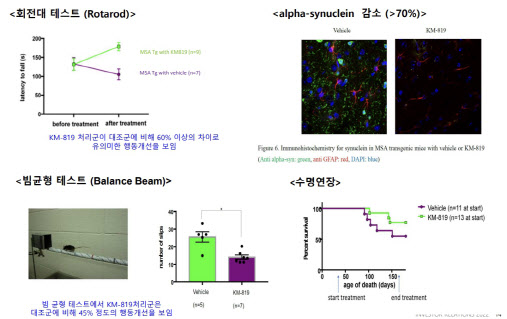
 | | ‘KM-819’의 다계통위축증(MSA) 전임상 결과. 카이노스메드는 ‘KM-819’가 MSA로 인한 행동장애를 개선시킬 수 있다는 상관관계를 동물 모델을 통해서 확인했다. (자료=카이노스메드) |
|
MSA는 몸이 뻣뻣해지고 움직임이 느려지는 파킨슨병 증상과 비틀거리며 말을 더듬는 소뇌 증상이 동반되는 신경 질환이다. 초기 증상이 파킨슨병과 유사해 구분이 어려운데 증상 진행속도는 더 빠르다. 일반적으로 첫 징후 증상이 나타난 이후 기대여명이 평균 8년 수준으로 알려져 있다. 치료가 시급한 희귀난치성 질환인 만큼 회사측은 임상 2상 후 희귀의약품 지정 가능성을 기대하고 있다. 마지막 환자 등록 후 19개월 간 투약을 진행하면 임상 2상이 종료되는데 마스터 임상인 최초 9개월의 투여 후 1차 평가가 예정돼 있다.
해당 임상은 국내에서만 진행되지만 회사측은 임상 2상 결과를 토대로 미국에서 글로벌 임상을 진행할 수 있을 것으로 기대하고 있다. 회사 관계자는 “국내에서만 진행되는 임상이지만 글로벌 임상시험수탁기관(CRO)이 미국 FDA 기준에 맞춰 진행하는 것이고, 내부적으로는 KM-819 작용기전이 인종간 차이가 없다고 보고 있다”며 “MSA는 희귀질환으로서 환자들에게 선택지가 많지 않기 때문에 임상 2상 결과가 좋을 경우 이 내용으로 미국에서 임상 3상 허가를 받을 가능성이 열려 있다”고 말했다.





![더블유에스아이, ‘유봇’으로 의료로봇 도전장[인베스트 바이오]](https://image.edaily.co.kr/images/vision/files/NP/S/2025/07/PS25071300096b.jpg)
![인투셀, 특허이슈에 장외 하한가…퓨쳐켐, 진단제 국내 품목허가 추진[바이오 맥짚기]](https://image.edaily.co.kr/images/vision/files/NP/S/2025/07/PS25071000247b.jpg)
![[한주의 제약바이오]프로젠 "차별화된 비만약 연구 구두발표 선정"](https://image.edaily.co.kr/images/content/defaultimg.jpg)

