[이데일리 김새미 기자]
삼진제약(005500)은 국내 판매를 맡고 있는 웨어러블 심전도기 ‘에스패치-EX(S-Patch Ex)’가 미국 식품의약국(FDA) 승인을 받았다고 6일 밝혔다.
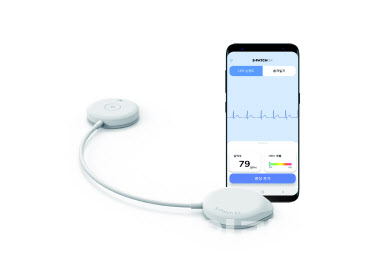 | | 웨어러블 심전도기 ‘에스패치 EX’ (사진=삼진제약) |
|
에스패치는 2019년 삼성SDS로부터 스핀오프한 디지털헬스케어 스타트업 ‘웰리시스’가 개발·제조한 웨어러블 심전도 솔루션이다. 두께 6mm, 무게 9g인 제품으로 IP55 등급의 방수·방진 기능이 있고, 부정맥·심장질환 진단을 서포트한다. 에스패치-EX는 부착 시 높은 착용 편의성, 정확한 진단 결과, 가독성이 우수한 심전도 결과 레포트 제공 등의 장점이 있다.
특히 에스패치-EX는 기존 ‘홀터’ 심전도계가 가지고 있던 환자와 의료진의 불편함을 해소시킨 제품이다. 홀터는 고가의 소프트웨어 구매·유지·보수가 필요할 뿐 아니라 검사를 받은 환자가 병원에 방문해야만 의료진이 해당 심전도 데이터 판독이 가능하다는 단점이 있었다.
에스패치-EX는 모바일 앱과 기기에서 사용자의 증상 기록이 가능하며 기록된 증상이 자동으로 소프트웨어에 표시돼 환자 관리가 수월하다. 검사 종료 후 클라우드 서버로 데이터가 자동 전송되므로 환자가 기기를 병원에 반납하기 전에 판독이 가능해 환자의 병원 방문 횟수도 진료 상황에 맞게 조절할 수 있다.
에스패치는 국내 식품의약품안전처의 허가를 받아 현재 국내 의료진의 부정맥 진단에도 사용되고 있다. 유럽 CE, 호주 식품의약품안전청(TGA), 뉴질랜드 의약품의료기기안전청(MEDSAFE)에 의료기기 등록을 마치고 전 세계 14개국에 제품을 제공 중이다.
에스패치-EX는 이번 미국 FDA 승인으로 다시 한번 해외에서의 기술력과 안전성을 입증 받았다. 회사 측은 이번 승인이 향후 제품 신뢰도 향상, 국내 시장 점유율 상승에 긍정적인 영향을 끼칠 것으로 기대하고 있다. 삼진제약 헬스케어팀 관계자는 “에스패치-EX의 미 FDA 승인은 웨어러블 심전도 검사 시장 중 최대 규모로 평가 받는 미국에서 제품의 안전성과 유효성을 인정받았다는데 큰 의미가 있다”고 말했다.
삼진제약은 에스패치-EX를 통해 환자들의 부정맥 조기 진단뿐 아니라 일반인의 건강검진 서비스, 심장 질환 퇴원 환자의 사후 관리 등, 활용 가능한 분야 발굴에 적극적으로 나설 예정이다. 또한 에스패치-EX 심전도 모니터링 시스템이 더욱 폭넓게 사용될 수 있도록 지원할 예정이다.



![[임상 업데이트] LG화학, 경구용 희귀비만 신약 2상서 체중 감소 효과](https://image.edaily.co.kr/images/vision/files/NP/S/2025/07/PS25071200105b.jpg)



![인투셀, 특허이슈에 장외 하한가…퓨쳐켐, 진단제 국내 품목허가 추진[바이오 맥짚기]](https://image.edaily.co.kr/images/vision/files/NP/S/2025/07/PS25071000247b.jpg)

