[이데일리 김유림 기자] 아리바이오가 주관사를 선정하고 본격적으로 기업설명회(IR)에 나섰다. 다만 핵심 파이프라인 ‘AR1001’ 임상 데이터 분석에 들어간 기관투자자들은 크게 네 가지의 의문을 제기하고 있다. 위약군이 없는 결과와 통계 달성 여부, 1차 임상인 26주까지의 결과 공개, 물질특허 만료 해결 방안 등이 그것이다.
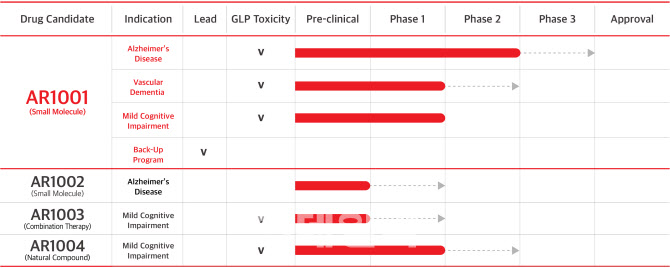 | | 아리바이오의 치매 및 신경 손상 관련 신약후보 물질은 현재까지 총 4개로 가장 대표적인 것이 2021년 3월 미국에서 임상 2상에 성공한 경구용 알츠하이머치료제 ‘AR1001’이다. 이밖에도 AR1002(전임상 완료), AR1003(전임상 완료), AR1004(임상 1상 완료)등이 치매 신약후보 물질로 개발되고 있다. (제공=아리바이오) |
|
28일 투자은행(IB) 업계에 따르면 아리바이오는 미래에셋증권을 대표주관사로, 하이투자증권을 공동주관사로 선정해 상장을 추진 중이다. 아리바이오의 기업 가치 대부분을 차지하고 있는 파이프라인은 알츠하이머 치료제 AR1001이다. 아리바이오는 학회 및 보도자료를 통해 AR1001이 성공적으로 미국 임상 2상을 마쳤다고 발표해 왔으며, 기관투자자들은 데이터 분석에 돌입한 것으로 전해진다.
크리니컬트라이얼 위약군 존재, 공개 데이터에선 부재 미국 국립보건원(NHI) 임상시험 사이트인 크리니컬 트라이얼에는 AR1001 미국 임상 2상 제목이 ‘경증에서 중등도의 알츠하이머 환자를 대상으로 AR1001의 26주간 치료의 효능과 안전성을 평가하기 위한 이중 맹검, 위약 대조 연구(A Double-Blind, Randomized, Placebo-Controlled Study to Evaluate Efficacy and Safety of 26-Week Treatment of AR1001 in Patients With Mild to Moderate Alzheimer‘s Disease)’라고 등록돼 있다. 위약군(플라시보군, 대조군) 70명, 투약군 10mg 70명, 30mg 70명으로 총 210명의 환자가 임상에 참여한다.
아리바이오에 따르면 첫 번째 1차평가지표 ADAS-Cog 13(인지기능 평가지표)은 AR1001 투약군 10mg, 30mg에서 각각 임상시험 시작점(Base Line)과 비교해 1.17점, 0.76점 감소했다. 위약군이 약 5.5점 감소하는 것을 고려하면, AR1001 투약군의 인지기능 악화 속도가 현저히 개선되는 것을 의미한다고 회사 측은 설명했다. 두 번째 1차 유효성 평가지표인 ADCS-CGIC(인지, 행동 및 기능평가)도 시작점과 비교해 10mg 0.13점, 30mg 0.37점 줄어들었다.
하지만 해당 데이터는 26주가 아닌 52주의 임상 결과다. 특히 위약군 결과값은 아리바이오 임상에서 확보한 수치가 아니며, P값 확보 여부도 불명확했다. 임상 시험의 기본은 위약군과 투약군의 모든 조건을 동일하게 설정해 최종 비교하는 것이다. 대표적으로 젬백스의 알츠하이머 치료제 GV1001 국내 임상 2상 결과 공시를 보면, 1차지표인 중증장애점수(SIB)에서 1.12mg 투약군이 12주, 24주 모두 위약군과 비교해 통계적으로 의미 있는 호전(p=0.0350, p=0.0405)을 보였다고 밝혔다.
시장의 이 같은 의문점 제기와 관련해 정재준 아리바이오 대표가 직접 설명했다. 정 대표는 “합성 신약의 알츠하이머 임상은 보통 26주까지 증상개선을 보고, 추가적으로 26주는 의약품으로서 가능성을 본다. AR1001도 26주까지는 위약군이 있었다”며 “추가 26주에서는 위약군도 AR1001을 투약하기로 미국식품의약국(FDA)과 합의를 했다. 이에 52주 데이터에서 자체적인 위약군이 없었던 것”이라고 말했다.
이어 “11월 알츠하이머 임상학회(CTAD)에서 발표를 할 때 주어진 시간이 20분밖에 없었고, 52주에 집중해서만 발표를 했던 거다”며 “위약군 5.5점은 약 7~8년 동안 했던 모든 알츠하이머 임상 데이터를 빅파마 화이자가 요약한 수치다. 메타분석이라고 하며, 그 데이터를 추론해서 사용한 거다”고 했다. 메타분석(meta-analysis)은 기존 연구 결과를 통계적으로 분석하는 방법이다.
정 대표의 설명을 종합해보면 26주 임상 이후 추가적으로 26주 임상을 진행하기로 하면서, 위약군에게도 AR1001 투여가 진행됐다. 따라서 처음부터 투약군이었던 환자들은 52주(26주+26주), 위약군은 26주의 투여를 받은 셈이다. 크리니컬트라이얼에는 52주 임상의 효능 평가 방식은 상세하게 나오지 않았다. 환자가 추가 임상에서 AR1001 10mg 또는 30mg에 선택적으로 연구에 참여 가능하다고 나와 있을 뿐이다. 따라서 26주 투여한 위약군을 52주 투약군과 어떤 방식으로 통합해 통계를 처리했는 지는 임상시험 결과보고서(CSR)가 공개되면 명확해질 것으로 예상된다.
“대조군 없는 데이터, REML 통계 통해 P값 달성했다” 52주 데이터의 P값 확보 여부에 대해서도 적극 해명했다. 임상 시험에서 P값의 기준 0.05라는 숫자는 중요하다. 100번의 실험을 해도 95번 이상 일정한 효능을 나타낸다는 의미이기 때문이다. 따라서 미국 식품의약국(FDA)은 통상적으로 1차평가지표 P값이 0.05 이상 나왔을 경우 해당 임상은 실패(Fail)라고 하고, 0.05 이하는 성공(Pass)적인 임상이라고 표현한다. 유명 저널 학회지에 게시된 임상 논문에서는 통상적으로 t-test, chi-square test, ANOVA 등의 통계 프로그램을 사용해 P값을 도출한다.
정 대표는 “다들 P값에 포커스를 맞추다 보면 와전될 수 있다. P값이 0.05가 나오는 통계는 위약군보다 수치가 올라가거나, 내려가는 것을 증명할 때 사용된다”며 “AR1001 52주 결과는 환자의 첫 투약시점 대비 증상이 얼마나 악화되지 않고, 유지가 됐는지를 비교해 통계를 도출했다. 레믈(REML)이라는 통계기법을 사용했으며, P값이 0.2 이상 나왔다. 레믈에서는 0.2 통계값을 통해 시작점과 비교해 증상이 더 악화되지 않았다라고 유의미하게 결론을 내린다”고 말했다.






![인투셀, 특허이슈에 장외 하한가…퓨쳐켐, 진단제 국내 품목허가 추진[바이오 맥짚기]](https://image.edaily.co.kr/images/vision/files/NP/S/2025/07/PS25071000247b.jpg)
![[임상 업데이트] LG화학, 경구용 희귀비만 신약 2상서 체중 감소 효과](https://image.edaily.co.kr/images/vision/files/NP/S/2025/07/PS25071200105b.jpg)

