팜이데일리 프리미엄 기사를 무단 전재·유포하는 행위는 불법이며 형사 처벌 대상입니다.
이에 대해 팜이데일리는 무관용 원칙을 적용해 강력히 대응합니다.
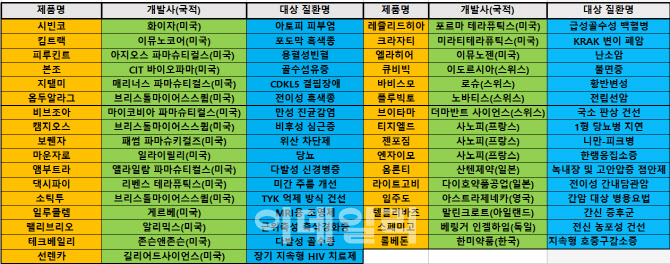
[이데일리 김진호 기자]2022년 미국식품의약국(FDA)은 총 33종의 신약을 승인했다. 지난해(50종) 보다 적은 신약이 미국에서 탄생했지만, 희귀 질환을 적응증으로 하는 약물이 과반 이상을 차지한다. 미국 브리스톨마이어스스큅(BMS)과 프랑스 사노피가 신약을 각각 3종씩 배출하며, 올해 미국에서 최다 신약을 승인은 기업이 됐다. 국내 개발사의 약물 중에서는
한미약품(128940)의 항암 치료제 ‘롤베돈’(한국 제품명 롤론티스)이 올해 미국에서 승인된 유일한 신약이 됐다.
 | | (제공=연합뉴스) |
|
22일 이데일리가 FDA의 신약 채널을 종합분석한 결과에 따르면, 올해 1월부터 이날까지 33종의 신약이 미국에서 탄생한 것으로 나타났다.
올해 승인 신약의 질환별로는 희귀 암 및 유전, 염증을 포함한 기타 질환(18종)이 과반 이상을 차지했다. 이외에도 항암(4종)과 염증(3종) 대사(3종), 정신(1종) 감염(2종) 안구(2종), 피부(1종). 진단용 물질 (1종) 등이 올해 개발된 것으로 집계됐다.
세계 최초라는 타이틀이 붙은 약물들이 크게 주목받았다. 지난 3월 FDA는 미국 매리너스 파마슈트컬스가 개발한 ‘지탤미’(성분명 가낙솔론)를 2세 이상 ‘사이클린 의존성 인산화효소 유사(CDKL)5’ 결핍장애 치료제로 최초 승인했다. 해당 질환은 X염색체에 존재하는 CDKL5 유전자 돌연변이로 인해 발생하며, 두뇌 발달과 기능 수행에 문제를 일으킨다.
FDA는 지난 4월 BMS가 개발한 최초의 비후성 심근증 치료제 ‘캠지오스’(성분명 마바캄텐)를 승인했다. 이어 8월에는 프랑스 사노피의 첫 니만-피크병 치료제 ‘젠포짐’(성분명 올리푸다이즈 알파)을 품목 허가했다. 비후성 심근증은 유전적 이유로 심장벽이 두꺼워지는 질환이다. 말기 심부전으로 진행될 수도 있다. 또 니만-피크병은 콜레스테롤 대사에 관여하는 NPC1 유전자의 돌연변이로 지질이 축적돼 문제를 일으키는 희귀 퇴행성 뇌질환으로 알려졌다.
이밖에도 미국에서 지난 9월 허가된 BMS의 ‘소틱투’(성분명 튜크라바시티닙)는 TYK2 억제 방식의 최초의 건선 치료제로 이름을 올렸다. 또 미국 이뮤노젠이 항체약물접합(ADC) 방식으로 개발한 ‘엘라히어’가 동종계열 중 최초로 미국에서 난소암 적응증을 획득했다. 엘라히어가 유방암 위주의 적응증을 획득해 왔던 기존 ADC 약물의 적응증 확대 가능성을 높인 것이란 평가다.
 | | 2022년 12월 22일 기준 미국 식품의약국(FDA) 신약 승인 현황.(자료=FDA, 그래픽=김진호 기자) |
|
2022년 한 해 동안 미국에서 신약개발에 성공한 기업의 국적을 보면, 미국이 20종으로 가장 많았다. 스위스(4종)와 프랑스(3종), 일본(2종) 등이 그 뒤를 이었다. 영국과 아일랜드, 독일, 한국 등의 개발사들은 올해 모두 1종씩의 신약을 미국에서 배출하는 데 그쳤다.
특히 BMS와 사노피는 각각 3종씩의 신약을 미국에서 배출한 것으로 확인됐다. BMS는 FDA로부터 앞서 소개한 캠지오스와 소틱투 외에도 이중 면역항암제 방식의 전이성 흑색종 치료제 ‘옵두알라그’(성분명 니볼루맙·렐라틀리맙)를 승인받았다.
사노피가 개발의 3종의 신약도 모두 희귀질환 또는 난치성 질환 치료제다. 회사는 FDA로부터 젠포짐을 비롯해 난치성 대사질환인 1형 당뇨병 지연제 ‘티지엘드’(성분명 테플리주맙)와 한랭응집소증 치료제 ‘엔자이모’(성분명 수팀리맙) 등의 품목 허가를 얻어냈다. 한랭응집소증은 적혈구에 저온반응성 자가항체가 결합해 응집 및 용혈 반응 등을 일으키는 희귀질환이다.
또 가장 최근인 22일(현지시간) FDA는 올해 33번째 신약으로 미국 길리어드 사이언스가 개발한 장기지속형 인간면역결핍바이러스(HIV) 치료제 ‘선렌카’(성분명 레나카파비르)를 승인하기도 했다.
국내 기업 중 유일하게 올해 미국 내 신약 배출에 성공한 한미약품은 자사의 롤베돈을 승인받은 지 1달 뒤인 10월부터 해당 제품을 미국 전역에서 시판한 것으로 알려졌다. 중증 호중구감소증 치료와 예방 용도로 개발된 롤베돈은 한미약품의 평택 바이오플랜트 공장에서 생산해 미국으로 공급되고 있다. 지난 16일 대신증권은 롤베돈이 2023년 미국 시장 전체의 약 2%(6000만 달러)를 차지하게 될 것이란 분석을 내놓기도 했다.
한편 미국 ‘네이터 리뷰 드럭 디스커버리’는 올해 미국에서 승인된 신약 중 5종이 2028년경 차기 블록버스터가 될 것으로 전망했다.
여기에는 △일라이릴리의 당뇨치료제 ‘마운자로’(성분명 티르제파타이드) △미국 앨나일람 파마슈트컬스의 아밀로이드 트렌스티테린 다발신경병증 치료제 ‘앰부트라’ △스위스 로슈의 황반변성 치료제 ‘바비스모’(성분명 파리시맙) △BMS의 캠지오스 △스위스 아르도시아의 불면증 치료제 ‘큐비빅’(성분명 다리도렉산트) 등이 포함됐다.
이중 5년 뒤 마운자로의 예상 매출액이 81억 달러로 가장 높게 전망됐다. 이어 앰부트라(27억 달러), 바비스모(18억 달러), 캠지오스(17억달러). 큐비빅(10억 달러) 순이었다.




![설탕세 도입 속속...국내도 찬성여론 높아[클릭, 글로벌 제약·바이오]](https://image.edaily.co.kr/images/vision/files/NP/S/2025/07/PS25070600443b.jpg)


![인투셀, 특허이슈에 장외 하한가…퓨쳐켐, 진단제 국내 품목허가 추진[바이오 맥짚기]](https://image.edaily.co.kr/images/vision/files/NP/S/2025/07/PS25071000247b.jpg)


