[이데일리 이광수 기자]
에이비엘바이오(298380)가 2거래일 만에 10.9% 하락했다. FDA가 에이비엘바이오가 파킨슨병 등 퇴행성 뇌질환 치료제로 개발하고 있는 파이프라인 ‘ABL301’의 임상1상 IND에 대해 부분 임상 보류 결정을 내려서다. 고용량 투여를 FDA가 허용하지 않은 건데, 업계에서는 안전성을 중요시 여기는 FDA의 기조에 따른 것으로 판단하고 있다.
“안전하게 진행되길 원하는 것” 13일 제약·바이오 업계에 따르면 에이비엘바이오는 전날 공시를 통해 “미국 FDA로부터 ABL301 1상 IND 심사결과 ‘부분 임상 보류(Partial Clinical Hold)’를 받았다고 밝혔다. FDA는 에이비엘바이오의 비임상 데이터는 ABL301을 사람에게 최대 20mg/kg까지만 투여할 수 있다는 것을 의미하며 이 용량을 초과하는 부분에 대해서는 임상시험을 할 수 없다는 것이다. 에이비엘바이오는 단일용량증량시험에서 최대 80mg/kg의 용량을 계획한 바 있다.
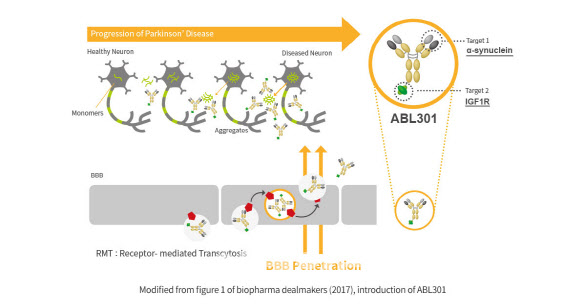 | | ABL301 (자료=에이비엘바이오) |
|
업계에서는 FDA가 뇌 질환 치료제 임상에서 보수적인 기조를 유지하고 있음을 확인하게 된 것으로 해석하고 있다. 바이오 업계 관계자는 “점점 뇌질환 쪽으로 까다로워지고 있다는 것”이라고 해석했다. 최근 업계에서 관심을 갖고 있는 알츠하이머병 치료제에서 발생한 부작용이 작용한 것이라는 설명이다.
앞서 뇌 질환의 한 종류인 알츠하이머병 치료제로 승인받은 바이오젠 ‘아두헬름’의 ARIA(뇌의 체액 저류 및 미세출혈) 부작용이 문제가 된 바 있었고, 최근 긍정적인 임상 3상 데이터를 발표한 바이오젠과 에자이의 알츠하이머병 후보 물질 ‘레카네맙’도 관련 부작용이 위약군(9%)대비 2배가량 높은 17.3%로 분석된 바 있다.
지난해 말 지명된 로버트 칼리프 미국 FDA가 과거보다 엄격한 잣대를 세우고 있다는 분석도 나왔다. 마약성 진통제 오피오이드 승인 책임자로 비판을 받은 바 있어서다. 허혜민 키움증권 연구원은 “뇌혈관장벽(BBB) 셔틀 플랫폼 기반의 첫 임상 진입이고 IGF1R 타겟으로도 처음이기 때문에 규제당국이 안전하게 진행되길 원하는 것으로 추측한다”고 말했다.
“임상 일정·비용 문제 없다” 개인투자자들의 궁금증은 임상 일정에 차질이 생기느냐다. 에이비엘바이오 관계자는 “저용량으로는 임상 시작을 할 것”이라며 “중국 우시바이오로직스에서 시약이 생산됐고, 미국에 보낼수 있도록 허가도 받았다”고 말했다.
일정은 미뤄지지 않는다는게 회사측 설명이다. 에이비엘바이오 관계자는 “저용량을 임상 하는 중에 고용량 임상을 위한 프로세스를 거칠 것”이라며 “저용량 임상이 끝날 즈음에 고용량 임상을 자연스럽게 시작할 수 있을 것”이라고 말했다. 고용량을 임상을 위해 따로 영장류 독성실험(GLP)을 진행해서 추가 데이터를 FDA에 제출해 고용량도 진행한다는 계획이다.
GLP 실험에 대한 추가 비용이 드는 것이 현재로서는 아쉬운 점이다. 에이비엘바이오 관계자는 “임상을 진행할만한 여유자금이 풍부해서 비용적인 문제는 걱정하지 않고 있다”고 설명했다. 올해 3분기 기준 에이비엘바이오가 보유한 예금 등 보유자금 합계는 연결기준 1633억원이다.






![[르포] 안드로이드 탄생한 보스턴CIC가보니…"K-바이오, 빅딜 마중물"](https://image.edaily.co.kr/images/vision/files/NP/S/2025/07/PS25071401146b.jpg)
![유한양행 ‘렉라자’ 글로벌 매출 급증에 20% ↑…제넥신·국전약품 上[바이오 맥짚기]](https://image.edaily.co.kr/images/vision/files/NP/S/2025/07/PS25071800211b.jpg)
![美FDA, 신약 허가 거절시 보완요구서한 공개[제약·바이오 해외토픽]](https://image.edaily.co.kr/images/vision/files/NP/S/2025/07/PS25071900105b.jpg)

