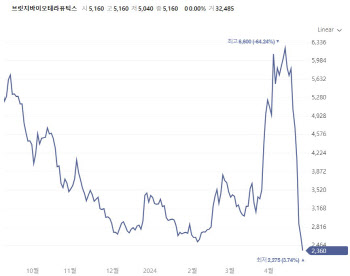
[이데일리 나은경 기자] 줄기세포 치료제 개발기업
코아스템켐온(166480)은 루게릭 환자를 대상으로 한 ‘뉴로나타-알 임상 3상 계획’ 및 ‘통계분석 계획’과 관련해 미국 식품의약국(FDA)과의 타입C(Type C) 미팅을 성공적으로 마쳤다고 18일 밝혔다.
회사는 마지막 환자 등록 이후 미팅을 준비해 왔으며 앞으로 생물학적 제제 시판허가(BLA) 제출 이전까지 추가 타입C 미팅 진행을 통해 FDA 가이드라인에 맞게 데이터를 준비하고 있는지 확인해 리스크를 줄여 나아가겠다는 계획이다.
회사 관계자는 “BLA 승인을 위한 약물의 효과 및 안전성의 보충 증거로써 현재 진행 중인 임상 3상이 적절하다는 답변을 받았다”며 “1·2차 유효성평가 변수 및 탐색적 변수 선택에 관한 내용도 FDA측으로부터 별다른 이슈가 없는 것으로 확인됐다”고 말했다.
이어 “이외 임상을 진행해 오며 확인이 필요한 부분에 대한 유의미한 답변 뿐만 아니라 운영과 향후 준비에 있어 보다 더 효율적인 의견을 더해준 점을 고려하면 이번 미팅은 성공적”이라며 “남은 기간 동안 이와 같은 기회들을 적극 활용해 임상 진행에 차질이 없도록 최선을 다 할 것”이라 덧붙였다.
타입C 미팅은 신약 개발 과정에서 임상 시험 책임 주체(개발사)의 요청에 의해 진행되는 회의다. 개발사가 신약의 개발, 심사와 관련해 FDA에 문의하고 답변을 받을 수 있다. 다만 회사측은 논의에 필요한 적절한 근거를 제시하지 못하거나 필수요소 등이 없다면 FDA가 답변을 거부할 수 있다는 점에서 이번 답변을 높이 평가하고 있다.
코아스템켐온은 임상 환자가 올해 모두 등록완료됨에 따라 내년 중 임상 3상 종료 계획이 차질없이 진행 될 것으로 전망하고 있다. 오는 2025년 초 BLA를 제출해 같은 해 FDA로부터 품목허가 승인을 받아 북미 시장 진출을 계획하고 있다.





 (좌측상단)
(좌측상단) (우측상단)
(우측상단) (우측상단)
(우측상단)





![[단독]글로벌 톱10 제약사, 신라젠 BAL0891 공동개발 협의중](https://image.edaily.co.kr/images/Photo/files/NP/S/2024/05/PS24050200372b.jpg)