[이데일리 이광수 기자]
유바이오로직스(206650)는 자체 개발 코로나19 백신 ‘유코백-19(EuCorVac-19)’의 임상 2상 중간결과를 확보했다고 29일 밝혔다.
유바이오로직스는 “임상 2상 중간결과 안전성 측면에서 임상약과 관련된 중대한 약물이상반응은 발생하지 않았다”면서 “ 2차 접종 이후 통증과 압통, 발열 등의 백신 이상반응이 1차 접종에 비해 낮아지는 경향으로 나타나 안전성과 내약성을 확인했다”고 밝혔다.
유바이오로직스는 지난 7월부터 은평성모병원 등 국내 5개 기관에서 만 19~75세의 건강한 성인 229명을 대상으로 유코백19의 2상을 진행했다. 현재 임상3상 비교임상 IND를 사전신청한 가운데, 국산기술로 전공정 국내생산이 가능한 우리 백신의 개발 성공에 대한 기대감이 한층 커지게 됐다는게 회사 측 설명이다.
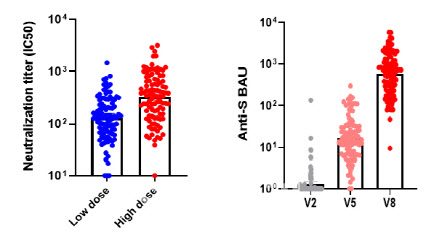
면역원성 평가에서 결합항체가 및 중화항체가(FRNT50%)는 국제백신연구소, 세포성면역은 가톨릭대 의과대학 백신·바이오연구소에서 각각 실시했다. 백신 2회 접종 완료 후 3주 경과 시점의 중화항체가는 저용량 대비 고용량에서 2.5배, WHO 표준혈청기준인 BAU 단위로 측정하는 결합항체가 역시 고용량에서 2.7배로 용량 비례성이 있음을 확인했다.
이는 고용량군에서 백신 투여 전보다 중화항체가는 약 26.5배, 결합항체가(BAU)는 Anti-RBD 항체의 경우 1040배, Anti-S 항체의 경우 455배 이상이며, 상업적으로 구입한 혈청패널(Access Biologicals LLC, USA)과 비교해 보면 회복기 환자혈청에 비해 약 9배 이상의 수치이다.
항체양전율(Seroconversion Rate)은 접종전 대비 중화항체가가 4배 이상 증가하는 기준에서는 95%이나, 정량한계 하한을 고려할 때 99%였다. 세포성 면역도 용량의존적으로 유의한 결과를 확인했다는게 회사 측 설명이다.
한편, 회사 자체의 추가분석에 따르면 유코백19 2상 접종자 혈청은 우한바이러스 대비 델타 변이주에 대해서 90%, 오미크론 변이주에서 9.5%의 교차반응을 보였다. 이는 회복기 환자 혈청패널 대비해서 각각 9배 및 13배 이상 높은 것으로 분석됐다.






![인투셀, 특허이슈에 장외 하한가…퓨쳐켐, 진단제 국내 품목허가 추진[바이오 맥짚기]](https://image.edaily.co.kr/images/vision/files/NP/S/2025/07/PS25071000247b.jpg)
![[임상 업데이트] LG화학, 경구용 희귀비만 신약 2상서 체중 감소 효과](https://image.edaily.co.kr/images/vision/files/NP/S/2025/07/PS25071200105b.jpg)

