[이데일리 나은경 기자] 글루카곤 유사 펩타이드(GLP)-1 계열 신약개발 전문기업 디앤디파마텍(347850)은 지난달 30일(현지 시간) 대사이상 관련 지방간염(MASH) 치료제 DD01의 미국 임상 2상 환자 모집을 성공적으로 완료했다고 4일 밝혔다.
DD01 임상 2상은 대사이상관련 지방간염(MASLD·MASH)을 동반한 체질량지수(BMI) 25㎏/㎡ 이상의 과체중 및 비만 환자 67명 이상을 대상으로 미국 내 약 12개 임상시험 실시기관에서 동시에 진행 중이다. 회사는 최대 48주간 무작위 배정, 이중 맹검, 위약 대조 및 평행 비교 방식을 통해 DD01의 효능과 안전성을 평가하고 있다.
DD01은 디앤디파마텍이 자체 개발한 장기 지속형 GLP-1·글루카곤 이중 수용체 작용제로, 뛰어난 지방간 감소 효과에 기반해 지난해 3월 미국 식품의약국(FDA)으로부터 패스트트랙 약물로 지정됐다.
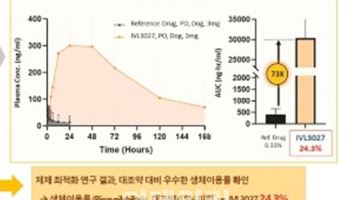
이번 임상 2상 연구의 1차 평가지표는 MRI-PDFF 측정 방법을 통한 투약 전 대비 12주 차 지방간이 30% 이상 감소한 환자의 비율이다. 이르면 오는 6월 중 그 결과를 확인할 수 있을 것으로 예상된다. 해당 평가지표는 이미 지난 2023년 완료된 임상 1상에서 4주 간의 짧은 투약 만으로도 고용량군에서 최대 88%의 통계적으로 유의한 결과를 달성한 바 있다. 회사측은 이번 임상시험에서 추가투약(12주)을 통한 DD01의 빠른 지방간 감소 효과를 다시 한번 입증하는 계기가 될 것으로 기대하고 있다.
특히 동일한 평가지표에서 이미 MASH 치료제로 세계 최초로 허가 받은 마드리갈의 ‘레즈디프라’(6주·68%)와 더불어 비만치료제로서 세계적으로 각광받고 있는 노보 노디스크의 세마글루타이드(72주·74%) 및 일라이 릴리의 ‘터제파타이드’(52주·81%)의 장기 투여 결과에 비해서도 월등한 효과를 확인했다. 회사 관계자는 “향후 본 후보물질이 지닌 계열 내 최고 신약(best-in-class)으로써의 잠재력을 재확인할 수 있을 것”이라고 말했다.
회사는 이 밖에 추가적으로 48주간 임상을 지속하여 조직 생검을 통한 MASH 해소 및 섬유증 개선 등 FDA로부터 요구되는 MASH 치료제 허가 요건의 확인과 더불어 지방간, 당화혈색소, 체중 감소과 같은 평가지표를 함께 확인할 계획이다. 이르면 2026년 상반기 중 이와 같은 결과가 확인 가능할 전망이다.
이슬기 디앤디파마텍 대표는 “MASH 치료와 관련해 상존하는 미충족 수요를 반영하듯, DD01 임상 2상의 환자 모집이 예상보다도 더욱 빠르게 완료됐다”며 “최근 발표되는 다양한 임상에서 GLP-1과 함께 간에 직접 작용하는 글루카곤 수용체를 동시에 타깃하는 GLP-1/GCG 이중 작용제가 다시금 주목받고 있다. 이같은 추세가 DD01의 성공적인 환자 모집을 앞당기는데 주효했을 것”이라고 추정했다. 이어 그는 “DD01은 이미 임상 1상에서 단 4주 간의 투여로 MASH치료제 허가요건과 밀접하게 연관된 것으로 알려진 지방간 수치를 50% 이상 감소시키는 효능을 보여줬다. 임상 2상을 통해 결과가 재현되는 경우 글로벌 기술이전 또한 빠르게 추진할 수 있을 것”이라고 말했다.



![“콧물 줄줄” 비염, ‘빠른 효과’냐 ‘안 졸린 약’이냐…효과따라 다른약 고르세요[약통팔달]](https://image.edaily.co.kr/images/vision/files/NP/S/2025/05/PS25050500066b.jpg)


![녹십자, 알리글로 승부처는 2분기[인베스트 바이오]](https://image.edaily.co.kr/images/vision/files/NP/S/2025/05/PS25050400073b.jpg)
![이승주 오름테라퓨틱 대표 ‘ORM-5029’ 임상 중단 ‘쇼크’[화제의 바이오人]](https://image.edaily.co.kr/images/vision/files/NP/S/2025/05/PS25050500138b.jpg)