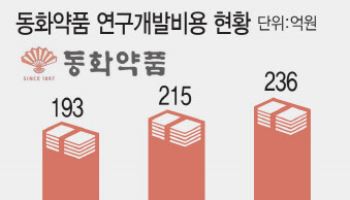
[이데일리 송영두 기자] 올해 상반기 국산 코로나19 백신이 탄생할 것으로 기대된다.
SK바이오사이언스(302440)가 개발 중인 코로나 백신이 그 주인공이 될 확률이 높다는 전망이다. 코로나19는 2019년 12월 중국 후베이성 우한시에서 발병을 시작했고, 전 세계로 빠르게 확산하자 세계보건기구(WHO)는 2020년 3월 11일 팬데믹(감염병 세계 대유행)을 선언했다.
각 국가는 코로나19를 예방하기 위한 코로나 백신과 치료제 개발 및 평가 가이드라인을 마련했다. 식품의약품안전처가 발표한 ‘국외 규제기관 코로나19 백신 심사 고려사항’ 리포트를 통해 코로나 백신이 허가를 받기 위해서는 어떤 부분을 입증해야 하는지 알아본다.
국산 코로나19 백신이 품목허가를 받기 위해서는 임상시험을 실시해야 한다. 백신의 유익성과 위험성 평가는 제조 및 품질, 비임상 결과 및 잘 설계된 임상시험에 대한 세부 정보를 기반으로 정확히 평가돼야 한다.
유효성 평가 먼저 품목허가를 위한 백신 유효성 평가는 기존 동반 질환이 있는 사람과 65세 이상이 포함돼야 한다. 또한 유효성을 입증하기 위해 최소 1개 이상의 잘 디자인된 대규모 3상 임상시험이 필요하다.
백신 유효성 평가를 위한 3상 임상시험 1차 평가 변수는 중증도와 관계없이 실험실적으로 확진된 코로나19 질환이어야 한다. 1차 평가 결과 분석 대상은 베이스라인 혈청 음성이었던 참가자에 한해 분석함으로써, 이전 바이러스 노출 경험이 없던 참가자에게 코로나19 감염 예방효과를 입증해야 한다.
3상 임상시험 유효성 평가를 위한 디자인과 통계적 검증을 고려할 때, 참가자 수 계산과 분석을 고려해 가설 수립 시 백신 유효성 기준은 점추정치로 최소 50% 이상, 95% 신뢰구간 하한은 최소 20%를 초과해야 한다. 바람직하게는 최소 30%를 초과해야 한다. 임상 결과는 기준에 만족해야 하고, 수용할만한 안전성 프로파일을 가지고 있어야 한다. 실제 결과가 백신이 대조군보다 우월한 것으로 판명되는 경우, 백신 개발자는 규제기관과 해당 데이터를 논의하도록 권고된다.
안전성 평가 또한 코로나 백신의 안전성 평가는 관련 가이드라인에 따라 수행된다. 허가 전 백신에 대한 유효성 시험이 수행되기 때문에, 수천 명의 사람들이 초기 시판 승인 시점에서 해당 백신에 노출될 수 있을 것으로 예상된다. 이에 따라 이러한 드문 형태의 위험을 평가할 수 있다. 백신의 이상반응 대부분은 접종 후 4~6주 이내에 발생한다. 원칙적으로 코로나 백신 조건부 시판 허가는 접종 후 최소 6주 후 안전성 데이터 검토를 기반으로 진행될 수 있다.
백신 투여 완료 후 최소 1년 동안, 무작위 그룹에 배정된 임상시험 참가자들을 대상으로 해당 백신에 대한 안전성 및 유효성을 추적 관찰해야 한다. 모든 참가자의 추적관찰이 최소 1년이 도달하기 전 유효성 중간분석에 근거해 조건부 허가된 후 최소 1년간 추적관찰이 권고된다. 시간 경과에 따른 코로나 감염 예방효과 감소 평가와 늦게 나타나는 이상반응 평가자료가 필요하다.
특히 백신 접종이 시작되자마자 발생하는 이상사례를 수집하고 분석을 위해 약물감시 시스템이 마련돼 있어야 한다. 평가를 위한 위해성 관리 계획(안)을 마련해, 실마리 정보가 감지되는 즉시 가능한 빨리 대처할 수 있도록 했다. 백신 접종 중 효과성 평가는 품목허가를 위한 임상시험보다 광범위하고 장기간의 평가가 중요하다. 약물감시와 효과성 평가 연구를 수행할 수 있도록 유럽 내 질병관리청과 회원국과 협력하고 있다.