팜이데일리 프리미엄 기사를 무단 전재·유포하는 행위는 불법이며 형사 처벌 대상입니다.
이에 대해 팜이데일리는 무관용 원칙을 적용해 강력히 대응합니다.
[이데일리 나은경 기자] GC
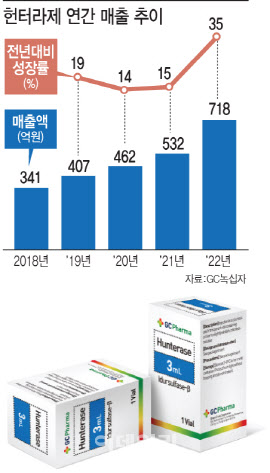
녹십자(006280)의 희귀질환치료제 ‘헌터라제’가 지난해 역대 최고 성적표를 받았다. 아직 중국에서 판매가 개시되지 않았음에도 성장률이 전년보다 두 배 이상 뛰었다는 점이 주목할 포인트다. 이 기세가 이어지고 올해 중국 출시까지 이뤄진다면 연내 단일 품목 매출 1000억원 돌파도 가능한 상황이다.
16일 GC녹십자에 따르면 지난해 헌터라제(성분명 ‘이두설파제-베타’)의 매출 성장률은 34~35%를 기록했다. 전년도 성장률인 15%의 두 배를 훌쩍 넘긴 수치다. 연 매출 규모는 712억~718억원에 달할 것으로 추정된다.
 | | [그래픽=이데일리 문승용 기자] |
|
‘2형 뮤코다당증’이라 불리는 헌터증후군은 이두설파제 효소 결핍으로 골격 이상, 지능 저하 등이 발생하는 선천성 질환이다. 여아 중에서는 환자가 거의 없고 남아 10만~15만명 중 1명의 비율로 발병하는데 제때 치료받지 못하면 15세를 넘기지 못하고 사망할 수도 있다. 평생 치료제를 처방받아야 하는데 약값은 연간 4억원으로 높아 적은 환자수에도 글로벌 시장 규모는 8000억~1조원에 달한다.
헌터라제는 세계에서 두 번째로 출시된 헌터증후군 치료제다. 최초 치료제는 프랑스 제약사 사노피의 희귀질환 치료제 사업부문인 젠자임의 ‘엘라프라제’다. 2006년 미국 식품의약국(FDA)에서 승인받았다. 국내에서도 2009년 식품의약품안전처(식약처)의 허가를 받아 시판 중이다. 엘라프라제와 헌터라제는 기전은 같고 효능은 유사하다. 하지만 GC녹십자는 국내에서는 저렴한 약가로 시장점유율을 80%까지 높였고, 해외에서는 엘라프라제가 판매되지 않는 나라를 집중 공략하면서 매출액을 빠르게 높여가고 있다.
엘라프라제가 미국, 유럽에서 주로 판매되고 있는 반면 헌터라제가 출시된 나라는 한국, 일본, 러시아, 이집트, 터키, 브라질 등 아시아나 중남미, 중동 국가가 대부분이다. 지난해 매출 성장세가 가팔랐던 것도 기존 출시국에서 점차 자리를 잡아가면서 해외 매출이 증가했기 때문이라는 것이 회사측 설명이다. 실제로 2021년 기준 헌터라제 해외 매출 비중은 61%였고 분기마다 수출 비중은 꾸준히 늘어나고 있다. 헌터라제는 중국에서도 2020년 9월 품목허가를 받아 현재 약가협상 중인데 업계에서는 연내 판매 개시 가능성을 점친다.
올해 독감 백신사업 매출 감소 및 비용지출 증가가 예상되는 상황에서 헌터라제는 GC녹십자의 기대주다. 지난해 GC녹십자의 전체 처방의약품 매출(3777억원)에서 헌터라제 매출은 약 20%를 차지했다. 회사측은 처방의약품 부문에서 주력 제품인 헌터라제의 매출 증가폭이 성장세를 이끌었다고 밝혔다. GC녹십자의 지난해 연 매출 1조2449억원(별도매출 기준)중 처방의약품 매출은 30%를 차지, 혈액제제 부문 다음으로 규모가 크다.
특히
SK바이오사이언스(302440)가 독감 백신 시장에 복귀하면서 경쟁이 불가피하고 대상포진 백신인 ‘CRV-101’ 개발 등으로 글로벌 임상 비용이 하반기 중 늘어날 전망이라, 헌터라제는 올해 ‘효자품목’의 지위를 굳건히 할 것으로 보인다. 회사측은 구체적인 올해 헌터라제 매출 전망치를 밝히지 않았지만 만약 지난해 수준의 성장률을 기록한다면 연 매출은 단숨에 970억원 수준으로 늘어나게 된다. 올해 중국 판매를 개시하며 성장률 기록을 경신한다면 1000억원 돌파도 기대해볼 수 있다.
앞으로 GC녹십자는 헌터라제 진출국가 확대보다 헌터라제ICV의 출시에 집중할 것으로 보인다. 헌터라제ICV는 머리에 디바이스를 삽입해 약물을 뇌실에 직접 투여함으로써 약물이 뇌혈관장벽(BBB)을 투과하지 못해 지능 저하 증상을 개선하지 못하는 기존 정맥주사 제형의 한계를 극복할 수 있다. 이 때문에 엘라프라제가 장악한 미국 및 유럽시장에서도 경쟁력을 갖출 수 있을 것으로 기대된다. 현재 헌터라제는 유럽의약청(EMA)로부터 희귀의약품지정(ODD)을 받은 상태로 추후 각국 허가당국과 논의해 순차적으로 헌터라제 및 헌터라제ICV 제형 출시를 논의할 예정이다.
헌터라제ICV 제형은 2021년부터 일본에서 시판 중이고 국내에서는 임상 1상이 진행되고 있다. GC녹십자 관계자는 “헌터라제ICV의 임상 2상 진행여부는 1상이 종료된 뒤 식약처와 상의해 결정해야할 부분”이라면서도 “제형변경이고 헌터증후군이 희귀질환이기 때문에 변수가 없다면 허가까지 걸리는 기간은 단축할 수 있을 것”이라고 설명했다.





!['저분자 혁신신약' 퍼스트바이오테라퓨틱스, 시리즈 D 성료[바이오 다크호스 펀딩]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/02/PS26020100564b.jpg)
![ABL바이오, 사노피 변수에 20만원선 붕괴…HLB·루닛도 악재 부각[바이오맥짚기]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/02/PS26020200183b.jpg)


