[이데일리 송영두 기자] 유전자치료제는 문제가 있는 유전자를 정상 유전자로 바꾸거나 치료 효과가 있는 유전자를 주입해 치료하는 의약품이다. 한국바이오협회 유전자치료제 개발 현황 리포트에 따르면 유전자치료에는 체세포 유전자 치료 방식과 생식세포 유전자 치료 방식이 있다.
유전자치료제 개발은 최근 세포치료제와 더불어 가장 주목받고 있다. 연평균 41.2%로 급격히 성장해 오는 2025년 약 120억 달러 규모로 확대될 것으로 전망된다. 현재 항암 유전자치료제 연구개발 비중이 높지만, 희귀질환을 중심으로 많은 기업이 비종양 분야 유전자치료제를 개발하고 있어 비종양 분야 연구개발 경쟁이 치열해지고 있다.
비종양 치료 영역에서는 임상 2상 중인 파이프라인이 88건으로 가장 많고, 전신 투여 형태의 파이프라인이 38건으로 가장 많다. 치료 타깃별로는 비종양 분야 유전자치료제 141개 중 54개 유전자치료제가 13개 적응증으로 분류됐다. 그 중 혈우병A와 파킨슨병 치료제가 가장 많았다.
대표적 비종양 유전자치료제는 노바티스가 개발한 근육위축증치료제 졸겐스마와 스파크 테라퓨틱스가 개발한 유전성 망막질환 치료제 럭스터나, GSK가 개발한 아데노신 디아미나아제결핍증 면역질환 치료제 스트림벨리스가 있다.
특히 노바티스 졸겐스마는 최근 국내에서도 허가를 받았다. 졸겐스마는 생존운동뉴런1(SMN1) 유전자가 돌연변이 등으로 기능을 하지 못해 발생하는 퇴행성 신경질환 척수성 근위축증 환자에게 정맥으로 단회 투여하는 치료제다. 식품의약품안전처는 지난 5월 28일 첨단바이오의약품으로 허가했다.
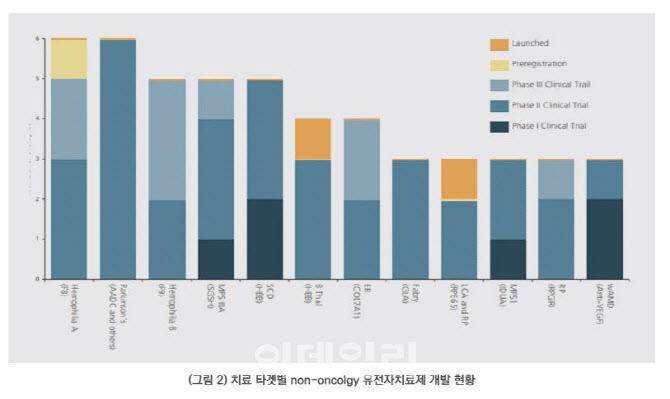 | | (자료=한국바이오협회) |
|
유전자치료제는 질병 치료를 위해 원하는 위치에 유전자가 정확하게 전달돼야 하며, 유전자 전달을 위해 바이럴 벡터인 아데노바이러스 레트로바이러스, 렌티바이러스, 아데노부속바이러스와 논 바이럴 벡터인 허피스바이러스, 리포좀, 플라스미드 등의 유전자 전달체가 활용된다.
바이럴 벡터는 전달 효율이 높은 장점이 있지만, 면역반응을 유발할 가능성이 높고 벡터 내 삽입할 수 있는 유전자 크기가 제한적이다. 바이럴 벡터는 인간, 침팬지 등에서 분리한 바이러스를 기반으로 유전자치료제 개발에 이용돼 왔지만, 최근 초기 단계 유전자치료제에 활용되는 바이럴 벡터는 유전공학적으로 조작된 형태가 많다.
반면 논 바이럴 벡터는 벡터 내 삽입 유전자 크기의 제한을 받지 않으며, 바이럴 벡터 대비 상대적으로 면역반응이 낮은 장점이 있다. 하지만 세포 내 도입 효율이 낮은 단점이 있다.
유전자치료제 전달체는 2021년 기준 글로벌 임상 중인 유전지치료제 3180개 중 아데노바이러스가 573건(17.5%)으로 가장 많이 활용되고 있다. 그 다음을 레트로바이러스가 536건(16.4%), 플라스미드가 482건(14.7%), 렌티바이러스 331건(10.1%), 아데노부속바이러스 263건(8.0%)가 차지했다.
한편 국내에서는 코오롱생명과학이 국내 최초 유전자치료제인 인보사를 개발해 허가를 받았지만, 허가 당시 기재된 세포와 다른 세포가 사용된 것으로 밝혀지면서 허가가 취소됐다. 이 외 네오진팜은 세계 최초로 발견한 간 섬유화 억제 유전자 ‘TIF1γ’를 활용한 유전자 치료제를 개발하고 있고, 아이씨엠은 아데노부속바이러스에 연골세포를 생성하고 노화를 막아주는 Nkx3.2를 활용한 퇴행성 관절염 유전자 치료제를 개발 중이다.







![성장 가능성에 기대감 쏠린 와이투솔루션·유투바이오 '上'[바이오맥짚기]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/02/PS26021900241b.jpg)

