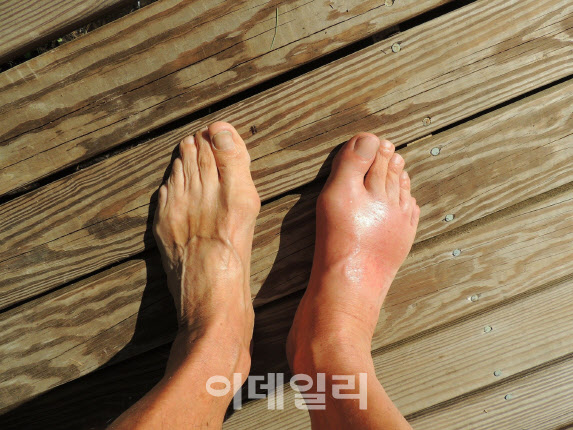
 | | (사진=JW중외제약 홈페이지) |
|
[이데일리 노희준 기자] 국내 제약회사들이 전 세계적으로 3조 규모로 형성된 통풍 치료제 시장 공략에 박차를 가하고 있다. 신약 개발에 있어 가장 힘들다는 임상 2상에서 잇단 효과 입증 사례가 나오면서 기대감도 커지는 상황이다.
5일 업계에 따르면,
LG화학(051910)은 최근 통풍 치료제 ‘LC350189’의 미국 임상 2상에서 유효성 평가지표를 충족해 신약 개발 가능성을 확인했다. 앞서
JW중외제약(001060)이 지난 3월 통풍 치료제 ‘URC102’의 국내 임상 2b상에서 유효성을 확인한 데 이은 성과다.
통풍은 단백질 분해 과정에서 나오는 노폐물인 요산이 체내에 과다하게 쌓여 생기는 관절염이다. 크게 요산이 체내에 너무 많이 생성되는 ‘과다생성형’과 요산이 제대로 배출되지 않는 ‘배출저하형’ 질환으로 구분한다. LG화학의 LC350189는 요산 과다 생성을 막아준다. 반면 중외제약의 URC102는 요산 배출을 촉진한다.
두 회사는 다른 기전 물질로 치료제를 개발 중이지만, 임상 2상에서 모두 안전성은 물론 유효성 지표의 통계적 유의성을 확보했다. 임상 결과가 우연에 의한 게 아니라 신뢰할 만하다는 얘기다. LG화학은 156명 환자를 대상으로 한 임상 2상에서 LC350189 50mg와 100mg, 200mg, 위약 등 총 4개군과 탐색적 대조군인 페북소스타트(Febuxostat)군으로 구분해 3개월간 시험을 진행했다. 페북소스타트는 가장 많이 쓰는 통풍치료제 성분이다.
임상에서 1차 평가지표인 ‘복용 3개월 시점의 혈청 요산 농도 5mg/㎗(1㎗=0.1ℓ) 미만 달성률’은 LC350189 200mg군이 62%로 나타났다. 반면 위약군 3%, 페북소스타트군이 23%로 나와 LC350189와 큰 차이를 보였다. LC350189 50mg, 100mg 등 저용량군의 달성률도 각각 47%, 45%로 높게 나타났다. 1차 평가지표는 회사가 임상에서 입증하려는 변수로 임상 성패를 가르는 중요 지표다.
JW중외제약도 지난 3월 171명을 대상으로 한 URC102의 국내 임상 2b상에서 유효성을 확인했다. URC102 9㎎, 6㎎, 3㎎ 투여군과 위약 등 총 4개군과 참조군인 페북소스타트 80㎎으로 구분해 12주 동안 약을 투여했다. 1차 평가변수는 ‘약물 투여 후 4주 시점에서의 혈청요산수치 6㎎/㎗ 이하 달성률’로 URC102 9㎎군 89%, URC102 6㎎군 72%, URC102 3㎎군 54%, 위약군 0%로 나타나 모든 URC102 투약군에서 통계적으로 유의했다.
시장조사기관 자료(Coherent Market Insights)에 따르면 전 세계 통풍 치료제 시장은 2019년 26억달러(약 3조원)에서 연평균 6.7% 성장해 2027년 43억달러(약 5조원)에 달할 전망이다. 국내 통풍 치료제 처방액은 2019년 340억원 규모로 2015년 230억원과 비교해 4년 만에 50%가량 급성장했다. 세계에서 가장 매출이 큰 제품은 일본 제약사 다케다의 ‘페브릭’(성분명 페북소스타트)이다. 업계 관계자는 “가장 어려운 임상 2상을 통과하면서 허가 획득은 물론 기술수출 가능성도 키우고 있다”고 말했다.
JW중외제약은 국내외 임상 3상을 검토하는 동시에 글로벌 기술수출을 추진 중이다. 앞서 2019년 중국 시장에 대한 URC102의 개발·판매 권리를 중국 심시어제약에 7000만달러(약 836억원) 규모로 이전했다. LG화학 역시 기술수출을 포함해 글로발 신약 개발을 위한 여러 방안을 모색 중이다.






![알테오젠, 일시적 투심하락 관망세 전환…삼양바이오팜 가파른 상승[바이오맥짚기]](https://image.edaily.co.kr/images/vision/files/NP/S/2026/01/PS26012300239b.jpg)

